ĐỀ CƯƠNG ÔN TẬP HỌC KÌ I – MÔN HÓA HỌC 11
LÝ THUYẾT
PHẦN I : AXÍT, BAZƠ VÀ MUỐI :
1. Axit khi tan trong nước phân li ra caction H+; Bazơ khi tan trong nước phân li ra anion OH-
2. Chất lưỡng tính vừa thể hiện tính axit, vừa thể hiện tính bazơ.
3. Hầu hết các muối khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit.
Nếu gốc axit còn chứa hidro có tính axit, thì gốc đó tiếp tục phân li yếu ra cation H+ và anion gốc axit.
4. Tích số ion của nước là KH O = [H+] [OH
O = [H+] [OH ] = 1,0 . 10-14. Một cách gần đúng có thể coi giá trị của tích số này là hằng số cả trong dung dịch loãng của các chất khác nhau.
] = 1,0 . 10-14. Một cách gần đúng có thể coi giá trị của tích số này là hằng số cả trong dung dịch loãng của các chất khác nhau.
6. Giá trị [H+] và pH đặc trưng cho các môi trường :
Môi trường trung tính: [H+] = 1,0 . 10-7M hay pH = 7,00
Môi trường axit : [H+] > 1,0 . 10-7M hay pH < 7,00
Môi trường kiềm : [H+] < 1,0 . 10-7M hay pH > 7,00
7. Màu của quỳ, phenolphtalein và chất chỉ thị vạn năng trong dd ở các giá trị pH khác nhau (xem SGK)
PHẦN II : PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI
1. Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau :
a) Chất kết tủa.
b) Chất điện li yếu.
c) Chất khí.
2. Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li. Trong phương trình ion rút gọn của phản ứng, người ta lược bỏ những ion không tham gia phản ứng, còn những chất kết tủa, điện li yếu, chất khí được giữ nguyên dưới dạng phân tử.
PHẦN III : TÍNH CHẤT CỦA NITƠ VÀ HỢP CHẤT CỦA NITƠ
1. Đơn chất Nitơ :
. Cấu hình electron nguyên tử: 1s22s22p3. Các số oxi hóa: -3, 0, +1, +2, +3, +4, +5.
. Phân tử N2 chứa liên kết ba bền vững (N ≡ N) nên nitơ khá trơ ở điều kiện thường.
2. Hợp chất của nitơ :
a) Amoniac: Amoniac là chất khí tan rất nhiều trong nước.
. Tính bazơ yếu :
- Phản ứng với nước : NH3 + H2O NH4+ + OH –

- Phản ứng với axit : NH3 + HCl NH4Cl
- Phản ứng với muối : Al3+ + 3NH3 + 3H2O Al (OH)3 + 3NH

. Tính khử : 2NH3 + 3CuO to N2 + 3Cu + 3H2O
b) Muối amoni
. Dễ tan trong nước, là chất điện li mạnh
. Trong dung dịch, ion NH4+ là axit yếu: NH + H2O NH3+H3O
+ H2O NH3+H3O
. Tác dụng với dung dịch kiểm tạo ra khí amoniac.

. Dễ bị nhiệt phân hủy.
c) Axit nitric :
. Là axit mạnh
. Là chất oxi hóa mạnh. +4 +2 +1 0 -3
– HNO3 oxi hóa được hầu hết các kim loại. Sản phẩm của phản ứng có thể là NO2, NO, N2O, N2, NH4NO3, tùy thuộc nồng độ của axit và tính khử mạnh hay yếu của kim loại.
– HNO3 đặc oxi hóa được nhiều phi kim và các hợp chất có tính khử .
d) Muối nitrat
. Dễ tan trong nước, là chất điện li mạnh.
. Dễ bị nhiệt phân hủy.
PHẦN IV: TÍNH CHẤT CỦA PHOTPHO VÀ CÁC HỢP CHẤT CỦA PHOT PHO
1. Đơn chất photpho :
Nguyên tử khối : 31
Độ âm điện : 2,19
P

Cấu hình electron nguyên tử : 1s2 2s22p63s23p3
Các số oxi hóa : -3, 0, +3, +5
P trắng | P đỏ |
Mạng tinh thể phân tử mềm, dễ nóng chảy độc, phát quang trong bóng tối, chuyển dần thành P đỏ, không tan trong nước, dễ tan trong một số dung môi hữu cơ. | Có cấu trúc polime, bền, không tan trong các dung môi hữu cơ. Chuyển thành hơi khi đun nóng không có không khí và ngưng tụ hơi thành photpho trắng.
|
+5
+O2 P2O5 
t0 +5 : photpho thể hiện tính khử
0 + Cl2 PCl5
P
+ Ca -3
Ca3P2 : photpho thể hiện tính oxi hóa
2. Axit photphoric :
. Là axit ba nấc, có độ mạnh trung bình.
. Không có tính oxi hóa.
. Tạo ra ba loại muối photphat khi tác dụng với dung dịch kiềm
3. Muối photphat
. Muối photphat gồm: Photphat trung hòa (Na3PO4, Ca3(PO4)2, …), đihidrophotphat (NaH2PO4, Ca(H2PO4)2, …), hidrophotphat (Na2HPO4, CaHPO4, …).
. Muối dễ tan trong nước gồm : - Tất cả các muối photphat của natri, kali, amoni.
- Đihidrophotphat của các kim loại khác.
. Muối không tan hoặc ít tan trong nước gồm : Hidrophotphat và photphat trung hòa của các kim loại, trừ của natri, kali và amoni.
. Nhận biết ion PO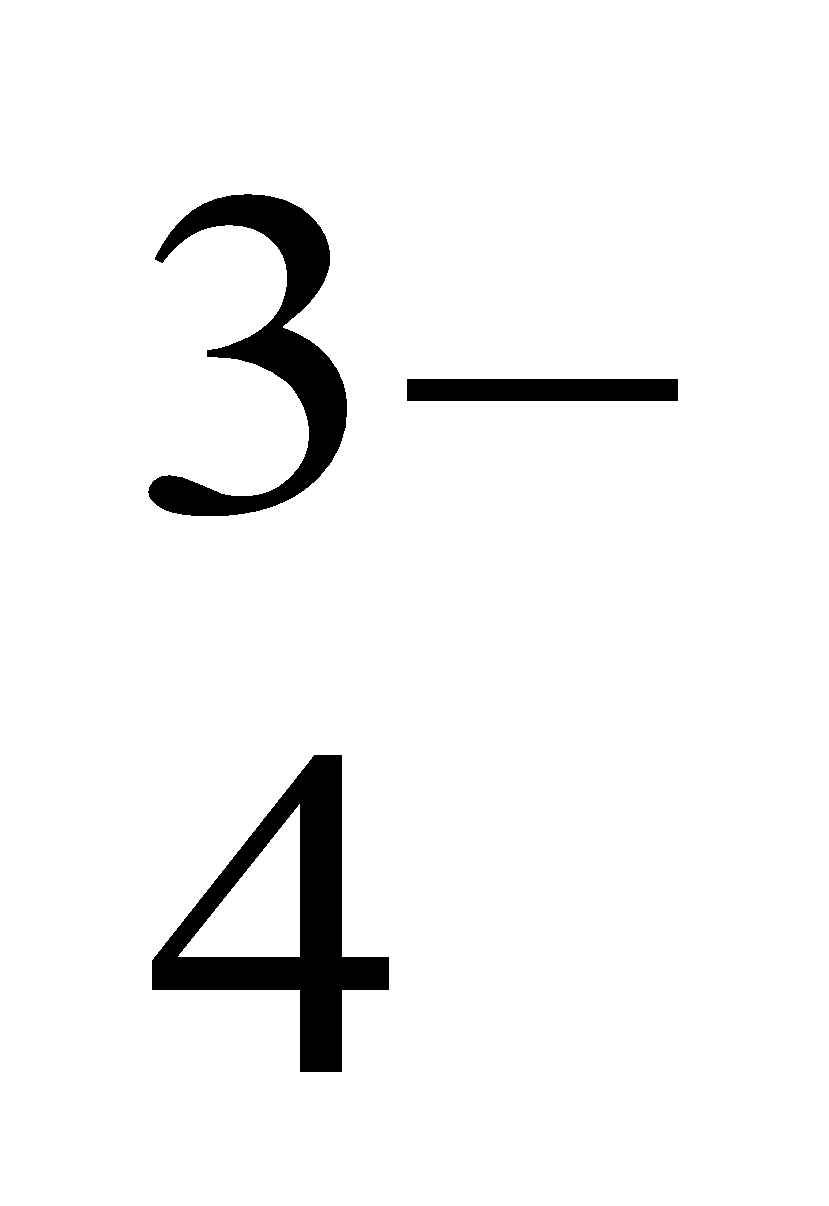 trong dung dịch muối photphat bằng phản ứng :
trong dung dịch muối photphat bằng phản ứng :
3Ag+ + PO Ag3PO4 Vàng
Ag3PO4 Vàng
PHẦN V: TÍNH CHẤT CỦA CACBON, SILIC VÀ HỢP CHẤT CỦA CHÚNG
| Cacbon | Silic |
Đơn chất | . Các dạng thù hình : kim cương, than chì, fuleren. . Cacbon chủ yểu thể hiện tính khử : 0 +4 C + 2CuO to 2Cu + CO2 . Cacbon thể hiện tính oxi hóa : 0 -4 C + 2H2 to , xt CH4 0 -4 3C + 4Al to Al4C3 | . Các dạng thù hình ; Silic tinh thể và silic vô định hình. . Silic thể hiện tính khử : 0 +4 Si + 2F2 SiF4 . Silic thể hiện tính oxi hóa : 0 - 4 Si + 2Mg to Mg2Si |
Oxit | CO, CO2 CO : là oxit trung tính; có tính khử mạnh +2 +4 4CO+ Fe3O4 to 3Fe + 4CO2 CO2 : là oxit axit, có tính oxi hóa +4 0 CO2 + 2Mg to C+ 2MgO . tan trong nước, tạo ra dung dịch axit cacbonic | SiO2 . Tan được trong kiềm nóng chảy : SiO2 + 2NaOH Na2SiO3 + H2O . Tác dụng với dung dịch axit HF : SiO2 + 4HF → SiF4+ 2H2O
|
Axit | Axit cacbonic (H2CO3) . không bền, phân hủy thành CO2 và H2O. . là axit yếu, trong dung dịch phân li hai nấc. | Axit silixic (H2SiO3) . là axit ở dạng rắn, ít tan trong nước. . là axit rất yếu, yếu hơn cả axit cacbonic |
Muối | Muối cacbonat . Muối cacbonat của kim loại kiềm dễ tan trong nước và bền với nhiệt. Các muối cacbonat khác ít tan và bị nhiệt phân : CaCO3 to CaO+ CO2 . Muối hidrocacbonat dễ tan và dễ bị nhiệt phân: Ca(HCO3)2 to CaCO3+ CO2 + H2O | Muối Silicat . Muối silicat của kim loại kiềm dễ tan trong nước. . Dung dịch đậm đặc của Na2SiO3, K2SiO3 được gọi là thủy tinh lỏng, dùng để sản xuất xi măng chịu axit, chất kết dính trong xây dựng, …
|
PHẦN VI: ĐẠI CƯƠNG HÓA HỮU CƠ
- Công thức tính mC, mH, mO và % của chúng trong hợp chất hữu cơ
- Nội dung thuyết cấu tạo hóa học; nhận biết và xác định được đồng đẳng với đồng phân
- Phân loại hợp chất hữu cơ và đặc điểm.
- Phân tích định tính và định lượng chất hữu cơ
* (lưu ý biểu thức tính % của các nguyên tố)
- Các công thức của hợp chất hữu cơ.
- Cách thiết lập công thức phân tử chất hữu cơ.
BÀI TẬP
A. TỰ LUẬN:
Câu 1: Hãy cân bằng các phản ứng sau bằng phương pháp thăng bằng electron:
1. C + HNO3 NO2 + CO2 + H2O. 5. Zn + HNO3
NO2 + CO2 + H2O. 5. Zn + HNO3  Zn(NO3)2 + N2 + H2O.
Zn(NO3)2 + N2 + H2O.
2. Al + HNO3 (l)  Al(NO3)3 + N2O + H2O. 6. Fe3O4 + HNO3
Al(NO3)3 + N2O + H2O. 6. Fe3O4 + HNO3  Fe(NO3)3 + NO + H2O
Fe(NO3)3 + NO + H2O
3. FeO + HNO3(l)  Fe(NO3)3 + NO + H2O 7. FeS + HNO3
Fe(NO3)3 + NO + H2O 7. FeS + HNO3  Fe(NO3)3 + H2SO4 + NO + H2O
Fe(NO3)3 + H2SO4 + NO + H2O
4. Al + HNO3  Al(NO3)3 + NH4NO3 + H2O. 8. Fe3O4 + HNO3
Al(NO3)3 + NH4NO3 + H2O. 8. Fe3O4 + HNO3  Fe(NO3)3 + NxOy + H2O
Fe(NO3)3 + NxOy + H2O
Câu 2 : Bằng phương pháp hóa học, hãy nhận biết các chất sau
a. HNO3, NaCl, HCl, NaNO3. b. (NH4)2SO4, NH4NO3, KCl, NaNO3.
c. NH4Cl, (NH4)2SO4, Na2SO4, NaNO3 (chỉ dùng một thuốc thử)
d. Na3PO4, NaCl, NaNO3, HNO3, HCl. e. O2, H2S, CO, CO2, SO2.
Câu 3: Hoàn thành các chuỗi phản ứng sau: (ghi đầy đủ điều kiện nếu có )
NH4NO3 NH3 Al(OH)3 NaAlO2 Al(OH)3 





a. (NH4)2CO3 NH3 Cu NO NO2 HNO3 NO





HCl AgCl 


b) Ca3(PO4)2 → P→ P2O5 → H3PO4 → Na2HPO4 → Na3PO4 → Ag3PO4
c) Na2CO3 →CO2 → Ca(HCO3)2 ⇄ CaCO3 →CO2
Câu 4: Viết phương trình phản ứng dạng phân tử và phương trình ion rút gọn (nếu có) giữa các cặp chất sau:
a) Al2(SO4)3 và NaOH b) NaHCO3 và NaOH c) NaHCO3 và HCl
d) Na2SO4 và HCl e) Al(OH)3 và NaOH f) Cu và HNO3 loãng
Câu 5: Cho 25,5 gam hỗn hợp Mg và Al tác dụng vừa đủ với V lít dung dịch HNO3 1M thu được 5,6 lít khí N2 (đktc, sp khử duy nhất) và dung dịch X.
a) Viết phương trình phản ứng xảy ra. b) Tính % khối lượng từng kim loại trong hỗn hợp.
c) Tính V d) Cô cạn dung dịch X thu được m gam chất rắn. Tính m
e) Tính thể tích dung dịch NaOH 1M cần cho vào dung dịch X để thu được kết tủa cực đại, cực tiểu, tính khối lượng kết tủa đó.
Câu 6: Hòa tan 46,4 gam hỗn hợp Cu và CuO trong 1,5 lít dung dịch HNO3 2M thu được 8,96 lít khí NO (đktc, sản phẩm khử duy nhất) và dung dịch X.
a) Tính % khối lượng của CuO trong hỗn hợp. b) Tính nồng độ mol/l của các chất trong dung dịch X.
c) Cô cạn dung dịch X thu được m gam chất rắn. Tính m.
Câu 7: Cho 17,9 gam hỗn hợp Al ; Fe và Cu tác dụng với dung dịch loãng HNO3 1M (vừa đủ) thu được 6,72 lít khí NO (đktc, sản phẩm khử duy nhất) và dung dịch X . Nếu cho m gam hỗn hợp trên tác dụng với dung dịch HCl dư thu được 5,6 lít khí (đktc).
a. Tính % khối lượng từng kim loại trong hỗn hợp b. Tính thể tích HNO3 đã dùng
c) Tính khối chất rắn thu được khi cô cạn dung dịch X.
d) Cho dung dịch NaOH dư vào dung dịch X thu được m gam kết tủa. Tính m.
Câu 8: Cho 17,4g hỗn hợp Al, Fe và Cu. Chia hỗn hợp này làm 2 phần bằng nhau. Phần thứ nhất cho vào HNO3 đặc, nguội thì có 2,24 lít (đktc) một chất khí bay ra (sản phẩm khử duy nhất). Phần thứ hai cho vào dung dịch HCl thì có 4,48 lít (đktc) một chất khí thoát ra. Tính khối lượng mỗi kim loại trong hỗn hợp đầu.
Câu 9: Hòa tan hoàn toàn 5,5g hỗn hợp gồm bột Zn và CuO trong 28 ml dung dịch HNO3 (vừa đủ) thu được 2,688 lít (đktc) khí màu nâu đỏ (sản phẩm khử duy nhất).
a) Tính % khối lượng mỗi chất trong hỗn hợp.
b) Tính nồng độ mol/l dung dịch HNO3 đã dùng.
Câu 10: a) Trộn lẫn 50ml dung dịch H3PO4 1,5M với 75ml dung dịch KOH 3M. Tính nồng độ mol của muối trong dung dịch thu được.
b) Tính thể tích dung dịch KOH 1,5M cần cho vào 75ml dung dịch H3PO4 2M để thu được dung dịch KH2PO4. Tính nồng độ mol của muối trong dung dịch này.
c) Đốt cháy hoàn toàn 12,4 gam P trong oxi dư. Hòa tan sản phẩm thu được vào 80ml dung dịch NaOH 25% (d =1,28 g/ml) thu được dung dịch X. Tính nồng độ phần trăm của các chất trong dung dịch X.
Câu 11: Cho 35 gam hỗn hợp Na2CO3 và K2CO3 tác dụng với dung dich HCl 0,5M (vừa đủ) thu được 6,72 lít khí (đktc) và dung dịch A.
a) Tính khối lượng từng chất trong hỗn hợp đầu. b) Tính khối lượng muối clorua tạo thành trong dd A.
c) Dẫn 6,72 lít khí trên vào V ml dung dịch Ba(OH)2 1M thu được 19,7 gam kết tủa. Tính V.
Câu 12: Đốt cháy hoàn toàn 3 gam hợp chất hữu cơ A thu được 4,4 gam CO2 và 1,8 gam nước. Biết tỉ khối của A so với He là 7,5. Tìm CTPT của A.
Câu 13: Chia m gam hỗn hợp gồm Fe(OH)3 và Al(OH)3 thành 2 phần bằng nhau.
Phần 1 cho phản ứng vừa đủ với 300ml dung dịch HCl 1M.
Phần 2 : cho từ từ dung dịch NaOH 2% cho đến khi kết tủa không còn tan nữa thấy cần 100g dd NaOH.
Tính m
Tính C% của dung dịch muối thu được ở phần 2
Câu 14: Phải dùng bao nhiêu lít khí N2 và bao nhiêu lít H2 để điều chế được 11,2 lít NH3. Biết rằng hiệu suất phản ứng chuyển hoá là 30%.
Câu 15: Cho 19 (g) hỗn hợp gồm Na2CO3 và NaHCO3 tác dụng với một lượng vừa đủ dung dịch HCl sinh ra 4,48(lít) khí (ở đktc). a. Viết các phương trình phản ứng xảy ra.
b. Tính khối lượng mỗi muối trong hỗn hợp ban đầu.
Câu 16: Khử 32 g Fe2O3 bằng CO dư, sản phẩm khí thu được cho qua bình đựng dung dịch nước vôi trong dư thì thu được a g kết tủa. Tìm giá trị của a.
Câu 17: Hợp chất X chỉ chứa C, H, O. Đốt cháy hoàn toàn 1,76 gam chất X thu được 3,52 gam khí CO2 và 1,44gam nước. Tỉ khối hơi của X so với không khí xấp xỉ 3,04. Xác định CTPT của A.
B. TRẮC NGHIỆM:
Dạng 1: Xác định nồng độ ion:
Câu 1: Trong 200 ml dd có hòa tan 20,2 gam KNO3 và 7,45 gam KCl. Nồng độ mol/l của [K+] trong dd là
A. 1,0M. B. 1,5M. C. 2,0M. D. 2,5M.
Câu 2: Nồng độ mol/l của ion kali và ion cacbonat có trong dung dịch K2CO3 0,05M lần lượt là:
A. 0,1M ; 0,05M. B. 0,2M ; 0,3M. C. 0,05M ; 0,1M. D. 0,05M ; 0,05M.
Câu 3. Trong dung dịch Al2(SO4)3 loãng chứa 0,6 mol SO42- thì dung dịch đó có chứa
A. 0,2 mol Al2(SO4)3 B. 0,6 mol Al3+ C. 1,8 mol Al2(SO4)3 D. 0,3 mol Al2(SO4)3
Câu 4. Trộn 50 ml dung dịch NaOH 0,2 M và 50 ml dung dịch Ba(OH)2 0,2 M được dung dịch X. Nếu bỏ qua sự điện li của nước thì nồng độ ion OH– trong dung dịch X là:
A. 0,2 M. B. 0,3 M. C. 0,5M. D. 0,4 M.
Câu 5: Một dung dịch chứa 0,02 mol Cu2+, 0,03 mol K+, x mol Cl- và y mol SO42-. Tổng khối lượng các muối tan trong dung dịch là 5,435 gam. Giá trị của x và y lần lượt là
A. 0,02 và 0,05. B. 0,03 và 0,02. C. 0,05 và 0,01. D. 0,01 và 0,03.
Dạng 2: pH của dung dịch:
Câu 1: Có 40 ml dung dịch HCl có pH = 1. Thêm vào đó x (ml) nước cất và khuấy đều thu được dung dịch có pH = 2 Giá trị của x là? A. 40 B. 100 C. 360 D. 500
Câu 2: Cho 350 ml dung dịch Ba(OH)2 0,25M. Thể tích nước (ml) cần cho vào dung dịch trên để thu được dung dịch có pH = 13 là A. 350 B.1400 C.1500 D.1750
Câu 3: Trộn lẫn 1500ml dd H2SO4 0,01M với 500ml dung dịch NaOH 0,064M. Dung dịch thu được có pH là?
A. 11 B. 3 C. 13 D. 12
Câu 4: Trộn 100 ml dd gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400ml dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M) thu được dd X. Giá tri pH của dd X là.
A. 7 B. 1 C. 2 D. 6
Câu 5: Trộn 100ml dung dịch có pH = 1 gồm HCl và HNO3 với 100ml dung dịch NaOH có nồng độ a (mol/l) thu được 200ml dd có pH = 12. Giá trị của a là:
A. 0,3. B. 0,12 C. 0,15. D. 0,03
Dạng 3: Phản ứng trao đổi ion: Tính khối lượng, thể tích, nồng độ:
Câu 1: Cho dung dịch chứa 0,1 mol (NH4)2SO4 tác dụng với dung dịch chứa 34,2 gam Ba(OH)2. Sau phản ứng thu được m gam kết tủa. Giá trị của m là
A. 33,2. B. 19,7. C. 23,3. D. 46,6.
Câu 2: Để tác dụng hết với dung dịch chứa 0,01 mol KCl và 0,02 mol NaCl thì thể tích dung dịch AgNO3 1M cần dùng là A. 40 ml. B. 20 ml. C. 10 ml. D. 30 ml.
Câu 3: Cho 0,01 mol FeCl3 tác dụng với dung dịch chứa 0,02 mol NaOH thì khối lượng kết tủa thu được là
A. 0,8 gam. B. 1,07 gam. C. 2,14 gam. D. 1,34 gam.
Câu 4: Cho dung dịch NaOH đến dư vào 100 ml dung dịch NH4NO3 0,1M. Đun nóng nhẹ, thấy thoát ra V lít khí NH3 (ở đkc). Giá trị của V là
A. 0,112 lit. B. 0,336 lit. C. 0,448 lit. D. 0,224 lit.
Câu 5: Trong dung dịch có thể tồn tại đồng thời các ion sau đây được không?
a) Na+, Cu2+, Cl-, OH-; b) NH4+, K+, Cl-, OH-.; c) Ba2+, Cl-, HSO4-, CO32-;
d) Fe2+, H+, SO42-, NO3-; e) Na+, Ba2+, HCO3-, OH-; f) K+, Fe2+, Cl-, SO42-;
g) Al3+, K+, OH-, NO3-; h) K+, Ba2+, Cl-, CO32-.
Dạng 4: Hiđroxit lưỡng tính:
Câu 1: Cho 300 ml dung dịch AlCl3 1M tác dụng với 500 ml dd NaOH 2M thì khối lượng kết tủa thu được là
A. 7,8 gam. B. 15,6 gam. C. 23,4 gam. D. 25,2 gam.
Câu 2: Cho 300 ml dung dịch ZnSO4 1M tác dụng với 400 ml dd NaOH 2M thì khối lượng kết tủa thu được là
A. 29,7 gam. B. 19,8 gam. C. 21,4 gam. D. 9,9 gam.
Câu 3: Cho dung dịch NH3 đến dư vào 20 ml dung dịch Al2(SO4)3. Lọc lấy kết tủa và cho vào 10 ml dung dịch NaOH 2M thì kết tủa vừa tan hết. Nồng độ mol/l của dung dịch Al2(SO4)3 đã dùng là
A. 0,5M. B. 0,25M. C. 0,35M. D. 0,65M.
Câu 4: Cho 200ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 15,6 gam. Gía trị lớn nhất của V là?
A. 1,2 B. 1,8 C. 2,4 D. 2
Câu 5: Cho 325 ml dung dịch KOH 1,2M tác dụng với 100 ml dung dịch AlCl3 x M thu được dd Y và 7,02 gam kết tủa. Giá trị của x là
A. 0,8. B. 1,2. C. 0,9. D. 1,0.
Câu 6*: Hòa tan hết m gam ZnSO4 vào nước được dd X. Cho 110ml dd KOH 2M vào X, thu được a gam kết tủa. Mặt khác, nếu cho 140 ml dung dịch KOH 2M vào X thì cũng thu được a gam kết tủa. Giá trị của m là
A. 20,125. B. 12,375. C. 22,540. D. 17,710.
Dạng 5: Điều chế amoniac:
Câu 1: Cho 4 lít N2 và 14 lít H2 vào bình phản ứng. Hỗn hợp thu được sau phản ứng có thể tích bằng 16,4 lít. (thể tích các khí được đo trong cùng điều kiện). Tính thể tích khí NH3 tạo thành và hiệu suất phản ứng?
A. 0,8 lít và 10%. B. 1,6 lít và 20%. C. 2,4 lít và 40%. D. 3,36 lít và 20%.
Câu 2*. Một hỗn hợp khí gồm N2 và H2 có tỉ khối so với hiđro là 4,9. Cho hỗn hợp đi qua chất xúc tác nung nóng được hỗn hợp mới có tỉ khối so với hiđro là 6,125. Hiệu suất tổng hợp NH3 là:
A. 42,85% B. 16,67% C. 40% D. 83,33%
Dạng 6: Xác định kim loại:
Câu 1. Cho 19,2 gam kim loại M tan hoàn toàn trong dung dịch HNO3 loãng thì thu được 4,48 lít khí NO (đktc, sản phẩm khử duy nhất). Kim loại M là
A. Cu. B. Zn. C. Fe. D. Mg.
Câu 2: Cho 10,725 gam kim loại M tác dụng với dung dịch HNO3 dư thu được 2464 ml khí NO (đktc, sản phẩm khử duy nhất). Kim loại M là.
A. Al. B. Mg. C. Cu. D. Zn.
Câu 3. Hoà tan hoàn toàn 16,2 gam kim loại M bằng dung dịch HNO3 thu được 5,6 lit (đktc) hỗn hợp 2 khí NO và N2 có khối lượng 7,2 gam. Kim loại M là:
A. Al. B. Cu. C. Zn. D. Fe.
Câu 4. Cho 3,024 gam một kim loại M tan hết trong dung dịch HNO3 loãng, thu được 940,8 ml khí NxOy (sản phẩm khử duy nhất, ở đktc) có tỉ khối đối với H2 bằng 22. Khí NxOy và kim loại M là
A. NO và Mg. B. N2O và Al C. N2O và Fe. D. NO2 và Al.
Dạng 7: Kim loại + HNO3
Câu 1: Khi hòa tan hoàn toàn 60,0 gam hỗn hợp đồng và đồng (II) oxit trong 3,0 lít dung dịch HNO3 1,00M lấy dư, thấy thoát ra 13,44 lít khí NO ( ở đktc).
a) Thành phần % của Cu trong hỗn hợp là: A. 48%. B. 72%. C. 60%. D. 96%.
b) Nồng độ mol/l của HNO3 trong dung dịch thu được (giả sử thể tích dung dịch thay đổi không đáng kể) là:
A. 0,08M. B. 0,18M. C. 0,26M. D. 0,34M.
Câu 2. Cho 2,8 gam hỗn hợp bột kim loại bạc và đồng tác dụng với dd HNO3 đặc, dư thì thu được 0,896 lít khí NO2 duy nhất (ở đktc). Thành phần phần trăm về khối lượng của bạc và đồng trong hỗn hợp lần lượt là:
A. 73% ; 27%. B. 77,14% ; 22,86% C. 50%; 50%. D. 44% ; 56%
Câu 3: Cho 4,76 gam hợp kim Zn và Al vào dd HNO3 loãng lấy dư thì thu được 896 ml (đo đkc) khí N2O (sản phẩm khử duy nhất). Thành phần phần trăm về khối lượng của kẽm và nhôm trong hỗn hợp lần lượt là:
A. 45,26% ; 54,74%. B. 54,62% ; 45,38% C. 53,62%; 46,38%. D. 44% ; 56%
Câu 4: Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 rất loãng thì thu được hỗn hợp gồm 0,015 mol khí N2O và 0,01 mol khí NO (phản ứng không tạo NH4NO3). Giá trị của m là.
A. 13,5 gam B. 1,35 gam C. 0,81 gam D. 8,1 gam
Câu 5: Cho m gam hỗn hợp Fe và Cu tác dụng với dung dịch HNO3 đặc nguội dư thu được 4,48 lít khí (đktc). Nếu cho m gam hỗn hợp trên tác dụng với dung dịch HCl dư thu được 5,6 lít khí (đktc). Giá trị m là.
A. 20,4. B. 25,2. C. 26,8. D. 15,4.
Câu 6*: Cho 2,16 gam Mg tác dụng với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lit NO (đktc) và dung dịch X. Khối lượng muối khan thu được khi làm bay hơi dung dịch X là.
A. 13,32 gam B. 6,52 gam C. 13,92 gam D. 8,88 gam.
Dạng 8: Nhiệt phân muối nitrat:
Câu 1: Nung một lượng xác định muối Cu(NO3)2. Sau một thời gian dừng lại để nguội rồi đem cân thấy khối lượng giảm 54 gam. Khối lượng Cu(NO3)2 đã bị phân hủy là :
A. 87 gam. B. 94 gam. C. 69 gam. D. 141 gam.
Câu 2. Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng A. 2. B. 3. C. 4. D. 1.
Câu 3: Đun nóng 66,2 gam Pb(NO3)2 sau phản ứng thu được 55,4 gam chất rắn. Hiệu suất của phản ứng là : A. 30%. B. 70%. C. 80%. D. 50%.
Câu 4: Nhiệt phân hoàn toàn 9,4 gam muối nitrat của kim loại M thu được 4 gam chất rắn. Kim loại M là
A. Cu. B. Zn. C. Fe. D. Mg.
Dạng 9: Xác định sản phẩm khử:
Câu 1: Cho 3,6 gam Mg tác dụng hết với dd HNO3 (dư), sinh ra 2,24 lit khí X (sản phẩm khử duy nhất). Khí X là. A. N2O B. NO C. NO2 D. N2
Câu 2*: Cho hỗn hợp gồm 6,72 gam Mg và 0,8 gam MgO tác dụng hết với lượng dư dung dịch HNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,896 lít một khí X (đktc) và dung dịch Y. Làm bay hơi dung dịch Y thu được 46 gam muối khan. Khí X là
A. NO2 B. N2O C. NO D. N2
Dạng 10: H3PO4 + dung dịch kiềm
Câu 1: Để thu được muối trung hoà, phải lấy V(ml) dung dịch NaOH 1M trộn lẫn với 50 ml dung dịch H3PO4 1M. Giá trị V là A. 150 ml. B. 200 ml. C. 250 ml. D. 300ml
Câu 2: Trộn lẫn 100 ml dung dịch NaOH 1M với 50 ml dung dịch H3PO4 1M. Nồng độ mol/l của muối trong dung dịch thu được là A. 0,35 M. B. 0,333 M. C. 0,375 M. D. 0,4 M.
Câu 3: Đổ dung dịch có chứa 39,2 gam H3PO4 vào dung dịch có chứa 44 gam NaOH. Khối lượng muối thu được khi làm bay hơi dung dịch là
A. 63,4 gam. B. 14,2 gam. C. 49,2 gam. D. 35 gam.
Câu 4: Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32%, tạo ra muối Na2HPO4.
a) Tính khối lượng dung dịch NaOH đã dùng? A. 2,5 gam. B. 5 gam. C. 50 gam. D. 25 gam.
b) Tính nồng độ phần trăm của muối trong dung dịch thu được?
A. 4,224%. B. 42,24%. C. 21,12%. D. 2,112%.
Dạng 11: CO2 + dung dịch kiềm và muối cacbonat:
Câu 1: Hấp thụ hoàn toàn 2,24 lít khí CO2 (ở đktc) vào dung dịch chứa 8 gam NaOH, thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là (Cho C = 12, O = 16, Na = 23)
A. 5,3 gam. B. 21,2 gam. C. 10,6 gam. D. 15,9 gam.
Câu 2: Cho 11,2 lít CO2 (đktc) lội chậm qua 200 ml dung dịch Ca(OH)2 2M. Sau phản ứng thu được bao nhiêu gam kết tủa? A. 40 gam. B. 50 gam. C. 30 gam. D. 15 gam.
Câu 3: Cho V lít khí CO2 (đktc) hấp thụ vào 2 lít dung dịch Ba(OH)2 0,015M thu được 1,97 gam kết tủa. Giá trị của V là A.0,224 B. 0,672 hay 0,224 C.0,224 hay1,12 D.0,224 hay 0,440
Câu 4: Hấp thu V lít khí CO2 (đktc) vào dd nước vôi trong thu được 10 gam kết tủa và khối lượng dung dịch giảm 3,4 gam. Giá trị của V là. A. 2,24. B. 3,36. C. 4,48. D. 5,60.
Câu 5: Cho V lít khí CO2 (đktc) hấp thụ hoàn toàn vào dung dịch Ca(OH)2, thu được 150 gam kết tủa và dung dịch X. Đun kỹ dung dịch X thu thêm được 50 gam kết tủa. Giá trị V là:
A. 11,2. B. 3,36. C. 4,48. D. 5,60.
Câu 6: Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mol/l, thu được 15,76 gam kết tủa. Gía trị của a là. A. 0,032 B. 0,048 C. 0,06 D. 0,04
Câu 7*: Sục 2,24 lít khí CO2 (đktc) 100 ml dung dịch chứa KOH 1M và Ba(OH)2 0,75M. Sau khi phản ứng xatr ra hoàn toàn thu được m gam kết tủa. Tính m
A. 19,7g B. 14,775g C. 23,64g D. 16,745g
Dạng 12: Xác định CT ĐGN, CTPT của HCHC:
Câu 1: Khi oxi hóa hoàn toàn 7,0 gam một hợp chất hữu cơ, người ta thu được 11,2 lít CO2 (đkc) và 9,0 gam H2O. Phần trăm khối lượng của từng nguyên tố C, H trong hợp chất hữu cơ đó là (Cho C = 12, O = 16)
A. 85,71% và 14,29%.B. 10,0% và 90,0%. C. 80,0% và 20,0%. D. 70,0% và 30,0%.
Câu 2: Đốt cháy hoàn toàn 3,0 gam một hợp chất hữu cơ X, người ta thu được 4,40 gam CO2 và 1,80 gam H2O. Công thức đơn giản nhất của hợp chất hữu cơ X là (Cho C = 12, O = 16, H = 1)
A. C2H4O. B. C2H5O. C. CH2O. D. CH2O2.
Câu 3: Đốt cháy hoàn toàn 10,4 gam hợp chất hữu cơ Y rồi cho sản phẩm lần lượt qua bình (1) chứa H2SO4 đậm đặc và bình (2) chứa nước vôi trong dư. Khi kết thúc thí nghiệm thì khối lượng bình (1) tăng 3,6 gam, bình (2) thu được 30 gam kết tủa. Khi hoá hơi 5,2 gam A thu được một thể tích đúng bằng thể tích của 1,6 gam oxi ở cùng điều kiện. Y có công thức phân tử là:
A. C5H12O. B. C3H4O4. C. C8H8. D. C7H4O.
---------Hết--------