ĐỀ CƯƠNG ÔN TẬP KIỂM TRA HỌC KỲ II - LỚP 12 ĐỀ THAM KHẢO SỐ 01 |
Cho H=1; C=12; N=14; O=16; S= 32; Li=7; Na=23; K=39; Cs=133; Al=27; Cu=64; Fe=56; Zn= 65; Cr=52; Ba=137. (Học sinh được dùng bảng tuần hoàn, bảng tính tan và máy tính cầm tay theo quy định.) Câu 1: Phản ứng nào sau đây đúng? A. 2Cr + 6HCl -> 2CrCl3 + 3H2 B. 4Cr + 3O2 -> 2Cr2O3
C. Cr + Cl2 -> CrCl2 D. Cr + MgCl2 -> CrCl2 + Mg Câu 2: Phát biểu nào sau đây không đúng?
A. Người ta có thể dùng thùng bằng nhôm để chuyên chở dung dịch HNO3 đặc nguội.
B. Bột nhôm bị bốc cháy khi tiếp xúc với khí Cl2.
C. Nhôm tan được trong dung dịch axit và dung dịch bazơ mạnh.
D. Vật dụng bằng nhôm bị gỉ nếu để lâu trong không khí. Câu 3: Dãy các chất đều tác dụng với CrO3 trong điều kiện thích hợp là
A. S, P, C, C2H5OH. B. S, C, CO2. C. S, P, C, KMnO4. D. P, S, MgO. Câu 4: Cho 1,68 gam hỗn hợp Cr và Cu vào dung dịch HCl loãng, nóng, dư thu được 448 mL khí (đktc). Lượng Cu có trong hỗn hợp là
A. 0,99 gam. B. 0,64 gam. C. 0,84 gam. D. 1,04 gam. Câu 5: Phát biểu nào sau đây không đúng khi so sánh tính chất hóa học của nhôm và crom?
A. Nhôm và crom đều bị thụ động hóa trong dung dịch H2SO4 đặc nguội.
B. Nhôm có tính khử mạnh hơn crom.
C. Nhôm và crom đều tan trong dung dịch NaOH loãng.
D. Nhôm và crom đều tan trong dung dịch HCl. Câu 6: Dung dịch CuSO4 phản ứng được với
A. Ag. B. Mg(OH)2. C. BaCl2. D. Fe(NO3)3. Câu 7: Công thức hóa học của kali cromat là
A. K2CrO4. B. KCrO2. C. K2Cr2O7. D. K[Cr(OH)4]. Câu 8: Cho các chất Cu, Al, HCl, CO. Nhóm các chất đều khử được Fe2O3 khi có điều kiện thích hợp là
A. Cu, Al, HCl, CO. B. Al, CO. C. CO, HCl. D. Al, HCl, CO. Câu 9: Cho từ từ 200 ml dung dịch NaOH 1,8M vào 100 ml dung dịch AlCl3 1M. Khối lượng kết tủa thu được là
A. 3,9 gam. B. 0,00 gam. C. 3,12 gam. D. 7,8 gam. Câu 10: Kim loại Fe phản ứng được với dung dịch
A. BaCl2. B. NaHCO3. C. Fe2(SO4)3. D. KNO3. Câu 11: Cho các kim loại Cu, Fe, Ag và các dung dịch HCl, CuSO4, FeCl2, FeCl3. Số cặp chất có phản ứng với nhau là
A. 3. B. 2. C. 5. D. 4. Câu 12: Hematit là một trong những quặng quan trọng của sắt. Thành phần chính của quặng là
A. Fe3O4. B. Fe2O3. C. FeCO3. D. FeO. Câu 13: Trong các chất sau đây, chất nào không có tính lưỡng tính?
A. Al2O3 B. AlCl3 C. Al(OH)3 D. ZnO Câu 14: Thí nghiệm nào sau đây thu được kết tủa khi phản ứng kết thúc?
A. Nhỏ dung dịch NaOH từ từ đến dư vào dung dịch AlCl3.
B. Nhỏ dung dịch HCl từ từ đến dư vào dung dịch Na[Al(OH)4] (hay NaAlO2).
C. Nhỏ dung dịch NH3 từ từ đến dư vào dung dịch Al(NO3)3.
D. Nhỏ dung dịch Ba(OH)2 từ từ đến dư vào dung dịch Zn(NO3)2. Câu 15: Dung dịch của chất nào sau đây không hòa tan được Al?
A. Ba(OH)2 B. NaHSO4 C. H2SO4 loãng D. NH3 Câu 16: Hòa tan m gam Cu vào 200 ml dung dịch FeCl3, sau khi phản ứng hoàn toàn thu được (m -7,68) gam chất rắn không tan. CM của dung dịch FeCl3 ban đầu là
A. 0,6M. B. 0,3 M. C. 0,9 M. D. 1,2 M. Câu 17: Hòa tan một đinh thép có khối lượng 1 gam chứa 98 % Fe, 1%C, 1%Cu trong dung dịch HCl dư (không tiếp xúc với không khí). Thể tích H2 sinh ra ở đktc là
A. 2,1952 lít. B. 0,784 lít. C. 3,92 lít. D. 0,392 lít. Câu 18: Điện phân nóng chảy Al2O3 với dòng điện có cường độ 9,65 A trong thời gian 3000 giây. Hiệu suất của quá trình điện phân là 80%. Khối lượng Al thu được là
A. 2,16 gam. B. 3,24 gam. C. 6,48 gam. D. 2,7 gam. Câu 19: Đốt cháy bột crom trong oxi dư thu được 2,28 gam một oxit duy nhất. Khối lượng crom bị đốt cháy là
A. 1,56 gam. B. 0,78 gam. C. 1,74 gam. D. 1,19 gam. Câu 20: Cấu hình của nguyên tử hoặc ion nào sau đây được viết đúng?
A. Cu: (Z= 29)[Ar]3d104s1 B. Cr: ( Z= 24) [Ar]3d44s2
C. Fe3+: [Ar]3d34s2 D. Fe (Z=26): [Ar]3d8 Câu 21: Hòa tan hoàn toàn 2 gam hỗn hợp Fe và Mg trong dung dịch HCl thu được 1,12 lít H2 (đkc) duy nhất. Cô cạn dung dịch sau phản ứng thu được m gam chất rắn khan. Giá trị của m là
A. 5,55. B. 5,65. C. 5,75. D. 5,45. Câu 22: Hòa tan 5,4 gam Al trong dung dịch HNO3 loãng, dư thấy thoát ra V lit khí N2 (sản phẩm khử duy nhất) ở đktc. Giá trị của V là
A. 1,68. B. 1,344. C. 2,668. D. 0,448. Câu 23: Cho dung dịch NaOH vào dung dịch Ca(HCO3)2 sẽ
A. có kết tủa trắng. B. có bọt khí thoát ra.
C. không có hiện tượng gì. D. có kết tủa trắng và bọt khí. Câu 24: Khử hoàn toàn 5,8 gam Fe3O4 bằng khí CO dư ở nhiệt độ cao, khí sinh ra sau phản ứng được dẫn vào dung dịch Ca(OH)2 dư thu được m gam kết tủa. Giá trị của m là
A. 15. B. 5. C. 2,5. D. 10. Câu 25: Trong một cốc nước có chứa các ion Ca2+, HCO3-, Cl-. Nước trong cốc là
A. nước cứng có tính cứng tạm thời. B. nước cứng có tính cứng vĩnh cửu.
C. nước cứng có tính cứng toàn phần. D. nước mềm. Câu 26: Một dây phơi quần áo gồm một đoạn dây đồng nối với một đoạn dây thép. Hiện tượng nào sau đây xảy ra ở chỗ nối hai đoạn dây khi để lâu ngày?
A. Đồng bị ăn mòn trước. B. Sắt bị ăn mòn trước.
C. Sắt và đồng đều không bị ăn mòn. D. Sắt và đồng bị ăn mòn đồng thời. Câu 27: Kim loại không tác dụng với nước ở nhiệt độ thường là
A. Sr. B. Mg. C. Be. D. Ca. Câu 28: Kim loại kiềm thổ (nhóm IIA) được điều chế trong công nghiệp theo phương pháp
A. điện phân nóng chảy. B. nhiệt luyện.
C. thủy luyện. D. điện phân dung dịch. Câu 29: Cho sơ đồ chuyển hóa:
Al2O3 -> X ddNH3 -> Y NaOH -> muối Z. Tên của Z là
A. nhôm nitrat. B. natri aluminat. C. nhôm clorua. D. natri aluminic. Câu 30: Kim loại Cr bị oxi hóa bởi chất nào sau đây tạo ra hợp chất Cr(II)?
A. Cl2 B. O2 C. S D. H2SO4 loãng |
|
|
|
ĐỀ KIỂM TRA HỌC KỲ II - LỚP 12 ĐỀ THAM KHẢO SỐ 02 Câu 1: Cho dãy các chất sau: Fe, Al, BaSO4, FeCl2, Cu(NO3)2, KNO3. Số chất trong dãy tác dụng được với dung dịch NaOH là: A. 2 B.3 C.4 D.5 Câu 2: Phản ứng nào sau đây đúng? Cr + MgCl2 🡪 CrCl2 + Mg C. 2Cr + 6HCl 🡪 2CrCl3 + 3H2 Cr + Cl2 🡪 CrCl2 D. 4Cr + 3O2 🡪 2Cr2O3
Câu 3: Hỗn hợp X gồm Al (0,2 mol), Fe (0,05 mol) và Cu (0,1 mol). Cho X tác dụng với dung dịch HNO3 loãng dư, sau phản ứng khối lượng dung dịch tăng 14,6 gam. Số mol HNO3 tham gia phản ứng là: 1,1875 mol B. 0,95 mol C. 1,1675 mol D. 0,75 mol
Câu 4: Nhôm hidroxit thu được khi: Cho khí CO2 vào dung dịch NaAlO2 C. Cho dung dịch NaOH dư vào dung dịch AlCl3 Cho Al2O3 vào nước D. Cho HCl dư vào dung dịch NaAlO2
Câu 5: Cho các ion kim loại Cu2+, Al3+, Ni2+, Fe2+ Thứ tự oxi hóa giảm dần theo thứ tự: Al3+, Fe2+, Cu2+, Ni2+ C. Al3+, Fe2+, Ni2+, Cu2+ Ni2+, Cu2+, Fe2+, Al3+ D. Cu2+, Ni2+, Fe2+, Al3+
Câu 6: Thêm từ từ vài giọt dung dịch bazo vào dung dịch muối Cr2O72-. Hiện tượng quan sát được là: Dung dịch muối không đổi màu C. Dung dịch chuyển từ màu vàng 🡪 màu cam Dung dịch chuyển màu cam 🡪 màu vàng D.Dung dịch chuyển màu cam 🡪 màu xanh
Câu 7: Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng và đun nóng, bởi vì: A. Tạo ra khí không màu hóa nâu trong không khí, dung dịch có màu xanh. B. Tạo ra kết tủa có màu vàng. C. Tạo ra khí không màu hóa nâu trong không khí, dung dịch có màu vàng. D. Tạo ra khí có màu nâu, dung dịch có màu xanh. Câu 8: Hòa tan hoàn toàn 12,2 gam hỗn hợp gồm FeCl2 và NaCl (tỉ lệ số mol tương ứng là 1:2) vào một lượng nước dư, thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là: 34,1 B. 28,7 C. 10,8 D. 57,4
Câu 9: Trong số hợp chất của Crom, chất nào sau đây là chất rắn, màu lục thẫm, không tan trong nước (ở điều kiện thường) CrO3 B. Cr2O3 C. Cr(OH)3 D. Na2Cr2O7
Câu 10: Dãy gồm các chất nào sau đây đều có tính lưỡng tính ? A. Al, Al2O3, Al(OH)3 , NaHCO3 B. Al, Al2O3, Al(OH)3, AlCl3 C. Al2O3, Al(OH)3, AlCl3, Na[Al(OH)4] D. NaHCO3, Al(OH)3, ZnO, H2O Câu 11: Nhúng một thanh nhôm nặng 50g vào dung dịch CuSO4. Sau phản ứng lấy thanh nhôm ra cân nặng 51,38g. Khối lượng Cu thoát ra là: 0,64g B. 1,28g C. 1,92g D. 2,56g
Câu 12: Cho 3,36 lít CO2 ở đktc vào 100ml dung dịch gồm Ba(OH)2 1M và NaOH 2M sẽ thu được bao nhiêu gam kết tủa? 9,85 B. 19,7 C. 29,55 D. 14,7
Câu 13: Phát biểu nào sau đây không đúng khi so sánh tính chất hóa học của nhôm và crom?
A. Nhôm và crom đều bị thụ động hóa trong dung dịch H2SO4 đặc nguội.
B. Nhôm có tính khử mạnh hơn crom.
C. Nhôm và crom đều tan trong dung dịch NaOH loãng.
D. Nhôm và crom đều tan trong dung dịch HCl. Câu 14: Dung dịch CuSO4 phản ứng được với
A. Ag. B. Mg(OH)2. C. BaCl2. D. Fe(NO3)3. Câu 15: Công thức hóa học của kali cromat là
A. K2CrO4. B. KCrO2. C. K2Cr2O7. D. K[Cr(OH)4]. Câu 16: Cho từ từ 200 ml dung dịch NaOH 1,8M vào 100 ml dung dịch AlCl3 1M. Khối lượng kết tủa thu được là: A. 3,9 gam. B. 0,00 gam. C. 3,12 gam. D. 7,8 gam. Câu 17: Cho các kim loại Cu, Fe, Ag và các dung dịch HCl, CuSO4, FeCl2, FeCl3. Số cặp chất có phản ứng với nhau là A. 3. B. 2. C. 5. D. 4. Câu 18: Cấu hình electron nào dưới đây được viết đúng ? Fe: [ Ar] 4s2 3d5 B. Fe2+: [ Ar] 4s23d4 C. Fe2+: [ Ar] 3d64s2 D. Fe2+: [ Ar] 3d6
Câu 19: Cho phương trình phản ứng : Al + HNO3 đ  Al(NO3)3 + NH4NO3 + H2O Al(NO3)3 + NH4NO3 + H2O Sau khi cân bằng tổng hệ số của phương trình là: 52 B. 56 C. 58 D. 60
Câu 20: Phát biểu nào sau đây không đúng: A. Nước mềm là nước không chứa hoặc chứa ít ion Ca2+, Mg2+. B. Nước cứng tạm thời là nước có chứa ion HCO3-. C. Nước cứng là nước có chứa nhiều ion Ca2+, Mg2+. D. Nước cứng vĩnh cữu là nước cứng có chứa ion Cl- hoặc SO42- hoặc cả hai. Câu 21: Một dây phơi quần áo gồm một đoạn dây đồng nối với một đoạn dây thép. Hiện tượng nào sau đây xảy ra ở chỗ nối hai đoạn dây khi để lâu ngày? A. Đồng bị ăn mòn trước. B. Sắt bị ăn mòn trước.
C. Sắt và đồng đều không bị ăn mòn. D. Sắt và đồng bị ăn mòn đồng thời. Câu 22: Điện phân nóng chảy Al2O3 với dòng điện có cường độ 9,65 A trong thời gian 3000 giây. Hiệu suất của quá trình điện phân là 80%. Khối lượng Al thu được là A. 2,16 gam. B. 3,24 gam. C. 6,48 gam. D. 2,7 gam. Câu 23: Cho sơ đồ chuyển hóa:
Al2O3  X X  Y Y  muối Z. Tên của Z là muối Z. Tên của Z là A. nhôm nitrat. B. natri aluminat. C. nhôm clorua. D. natri aluminic. Câu 24: Khử hoàn toàn 5,8 gam Fe3O4 bằng khí CO dư ở nhiệt độ cao, khí sinh ra sau phản ứng được dẫn vào dung dịch Ca(OH)2 dư thu được m gam kết tủa. Giá trị của m là
A. 15. B. 5. C. 2,5. D. 10. Câu 25: Cho sơ đồ phản ứng NaHCO3  X X  Y Y  Z Z  CO2. X, Y, Z lần lượt là CO2. X, Y, Z lần lượt là A. Na2SO4, Na2CO3, CaCO3. B. Na2CO3, NaCl, NaNO3. C. Na2CO3, CaCO3, Ca(HCO3)2. D. Na2CO3, NaCO3, Na2O. Câu 26: Lần lượt nhúng 4 thanh kim loại riêng biệt: Al, Zn, Fe, Cu vào dung dịch Cu(NO3)2.Sau một thời gian lấy các thanh kim loại ra. Kết luận nào dưới đây không đúng: Khối lượng thanh Al giảm đi C. Khối lượng thanh Cu không đổi Khối lượng thanh Fe giảm đi D. Khối lượng thanh Zn giảm đi.
Câu 27: Hòa tan hoàn toàn 2 gam hỗn hợp Fe và Mg trong dung dịch HCl thu được 1,12 lít H2 (đkc) duy nhất. Cô cạn dung dịch sau phản ứng thu được m gam chất rắn khan. Giá trị của m là A. 5,55. B. 5,65. C. 5,75. D. 5,45. Câu 28: Cho 4,86g Al tác dụng hết với dung dịch HNO3 loãng tạo ra 0,15mol NO (không có khí nào khác) và dung dịch A. Khối lượng muối trong dung dịch A là: 40,74 B. 32,85 C. 38,25 D. 28,25
Câu 29:Một hỗn hợp A gồm Al và Fe được chia 2 phần bằng nhau Phần I cho tác dụng với HCl dư thu được 44,8 lit khí (đktc) Phần II cho tác dụng với NaOH dư thu được 33,6 lit khí (đktc). Khối lượng Al và Fe có trong hỗn hợp là: A. 27g Al và 28g Fe B. 54g Al và 56g Fe C. 13,5g Al và 14g Fe D. 54g Al và 28g Fe Câu 30: Cho hỗn hợp bột Al, Fe vào dung dịch chứa Cu(NO3)2 và AgNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn gồm ba kim loại là: A. Fe, Cu, Ag. B. Al, Cu, Ag. C. Al, Fe, Cu. D. Al, Fe, Ag. ---------------HẾT---------------
ĐỀ KIỂM TRA HỌC KỲ II - LỚP 12 ĐỀ THAM KHẢO SỐ 03 Câu 1: Thí nghiệm nào sau đây không tạo ra muối Fe (III)? A. Cho Fe2O3 vào dung dịch HCl loãng, dư. B. Cho bột Fe đến dư vào dung dịch AgNO3. C. Cho Fe vào dung dịch HNO3 đặc, nóng, dư. D. Cho Fe(OH)2 vào dung dịch HNO3 loãng, dư. Câu 2: Phát biểu nào sau đây không đúng? A. Nhôm là nguyên tố phổ biến nhất trong vỏ Trái Đất. B. Bột nhôm bốc cháy khi tiếp xúc với khí clo. C. Vật bằng nhôm bền với không khí và nước. D. Nhôm được dùng làm dây dẫn điện thay cho đồng. Câu 3: Để kết tủa hoàn toàn Al(OH)3 từ dung dịch AlCl3 cần dùng lượng dư dung dịch A. NH3. B. NaOH. C. Ba(OH)2. D. AgNO3. Câu 4: Để bảo quản Na cần ngâm Na trong A. dầu hỏa. B. ancol. C. nước. D. dung dịch NaCl. Câu 5: Dung dịch muối X tác dụng với dung dịch NaOH, thu được kết tủa màu lục xám. X là A. MgSO4. B. CrCl3. C. FeSO4. D. FeCl3. Câu 6: Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thì A. không có hiện tượng gì. B. có kết tủa trắng và bọt khí. C. có bọt khí. D. có kết tủa trắng. Câu 7: Trường hợp nào sau đây thu được kết tủa sau khi phản ứng xảy ra hoàn toàn? A. Sục khí CO2 dư vào dung dịch Ca(OH)2. B. Cho dung dịch NaOH dư vào dung dịch AlCl3. C. Cho dung dịch Na3PO4 vào dung dịch Ca(HCO3)2. D. Cho CaCO3 vào dung dịch HCl loãng, dư. Câu 8: Trong thực tế, loại quặng thường được dùng làm nguyên liệu để sản xuất gang là A. xiđerit. B. pirit. C. boxit. D. hematit. Câu 9: Kim loại nào sau đây không phản ứng với dung dịch NaOH? A. Na. B. Al. C. Ba. D. Fe. Câu 10: Cho dãy các kim loại: Na, Cu, Al, K. Số kim loại trong dãy phản ứng với lượng dư dung dịch FeCl3 thu được kết tủa là A. 2. B. 4. C. 1. D. 3. Câu 11: Phát biểu nào sau đây không đúng? A. Al2O3 là hợp chất lưỡng tính. B. Al(OH)3 là kết tủa dạng keo. C. AlCl3 tác dụng được với dung dịch H2SO4. D. Al2O3 tác dụng được với dung dịch HCl. Câu 12: Nhận định nào sau đây không đúng? A. Trong dung dịch, ion Fe3+ có tính oxi hóa mạnh hơn ion Cu2+. B. Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2 xuất hiện kết tủa. C. Đơn chất Fe oxi hóa được Cu2+ trong dung dịch thành Cu. D. Trong dung dịch, ion Fe2+ vừa có tính oxi hóa, vừa có tính khử. Câu 13: Trong các chất: NaOH, Mg(OH)2, Ba(OH)2, KOH, chất có tính bazơ yếu nhất là A. Ba(OH)2. B. KOH. C. Mg(OH)2. D. NaOH.
Câu 14: Tiến hành các thí nghiệm sau: (a) Cho Na2O vào lượng nước dư. (b) Điện phân dung dịch NaCl có màng ngăn xốp. (c) Cho dung dịch NaHSO4 vào dung dịch Ba(HCO3)2. (d) Cho dung dịch NaHCO3 vào dung dịch Ca(OH)2 (tỉ lệ mol 1:1). Số thí nghiệm thu được NaOH là A. 1. B. 3. C. 4. D. 2. Câu 15: Cho các kim loại: Mg, Ca, Sr, Ba. Kim loại mạnh nhất là A. Sr. B. Ca. C. Ba. D. Mg. Câu 16: Ở điều kiện thường, kim loại có độ cứng lớn nhất là A. Cr. B. Fe. C. Cu. D. Al. Câu 17: Phát biểu nào sau đây không đúng? A. Dùng dung dịch HCl để làm mất tính cứng của nước cứng tạm thời. B. Nước tự nhiên thường có cả tính cứng tạm thời và vĩnh cửu. C. Nước cứng làm giảm tác dụng của xà phòng khi giặt quần áo. D. Nước chứa ít hoặc không chứa các ion Mg2+ và Ca2+ gọi là nước mềm. Câu 18: Chất rắn X là oxit axit có tính oxi hóa mạnh, bốc cháy khi tiếp xúc với S, P, NH3. Cho X vào dung dịch NaOH loãng, dư thu được dung dịch Y. Cho dung dịch H2SO4 loãng, dư vào Y, thu được dung dịch Z. Nhận định nào sau đây không đúng? A. Y có màu vàng. B. X có màu đỏ thẫm. C. Z có màu da cam. D. X có màu lục thẫm. Câu 19: Cho các phương pháp sau: (a) Gắn kim loại kẽm vào kim loại sắt. (b) Gắn kim loại đồng vào kim loại sắt. (c) Phủ một lớp sơn lên bề mặt sắt. (d) Tráng thiếc lên bề mặt sắt. Số phương pháp điện hóa được sử dụng để bảo vệ kim loại sắt không bị ăn mòn là A. 3. B. 2. C. 1. D. 4. Câu 20: Có thể phân biệt 4 ống nghiệm đựng riêng biệt các dung dịch loãng: FeCl3, NH4Cl, FeSO4 và AlCl3 bằng dung dịch A. AgNO3. B. NaOH. C. quỳ tím. D. BaCl2. Câu 21: Nhỏ từ từ đến dư dung dịch NaOH vào dung dịch Al2(SO4)3. Hiện tượng quan sát được là A. chỉ có kết tủa keo trắng. B. có kết tủa keo trắng, sau đó kết tủa tan. C. có kết tủa keo trắng và khí thoát ra. D. không có kết tủa, có khí thoát ra. Câu 22: Phương pháp thích hợp để điều chế Mg là A. dùng K khử Mg2+ trong dung dịch MgCl2. B. điện phân dung dịch MgCl2. C. nhiệt phân MgCl2. D. điện phân MgCl2 nóng chảy. Câu 23: Lượng Zn vừa đủ để khử Cr3+ trong dung dịch chứa 0,03 mol CrCl3 thành Cr2+ là A. 0,650 gam. B. 0,975 gam. C. 1,300 gam. D. 0,325 gam. Câu 24: Điện phân nóng chảy muối clorua một kim loại kiềm, thu được 0,896 lít khí (đktc) ở anot và 1,84 gam kim loại ở catot. Kim loại kiềm là A. Cs. B. Na. C. K. D. Li. Câu 25: Sục 0,448 lít khí CO2 (đktc) vào 100 ml dung dịch hỗn hợp gồm NaOH 0,06M và Ba(OH)2 0,12M, thu được m gam kết tủa. Giá trị của m là A. 1,182. B. 3,940. C. 2,364. D. 1,970. Câu 26: Hòa tan hoàn toàn 7,3 gam hỗn hợp X gồm Na và Al bằng nước thu được 0,25 mol H2. Số mol Na trong X là A. 0,15. B. 0,2. C. 0,25. D. 0,5. Câu 27: Hòa tan hoàn toàn 17,94 gam hỗn hợp X gồm Al, Al2O3 và Al(NO3)3 trong dung dịch chứa x mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,06 mol khí N2O duy nhất và dung dịch chỉ chứa một muối của kim loại. Giá trị của x là A. 0,48. B. 0,42. C. 0,45. D. 0,36. Câu 28: Để 5,6 gam Fe trong không khí, sau một thời gian thu được hỗn hợp rắn X. Toàn bộ lượng X tác dụng với dung dịch HNO3 loãng (dư), cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là A. 12,1. B. 24,2. C. 36,0. D. 18,0. Câu 29: Hòa tan hoàn toàn 0,3 mol hỗn hợp gồm FeO, Fe(OH)2, FeCO3 và Fe3O4 vào dung dịch chứa NaHSO4 và NaNO3, thu được dung dịch X. Chia X thành 3 phần bằng nhau: - Phần 1 hòa tan tối đa 3,52 gam bột Cu. - Cho từ từ 400 ml dung dịch NaOH 1M vào phần 2, thu được 11,77 gam kết tủa duy nhất. - Cô cạn phần 3, thu được m gam muối trung hòa khan. Biết rằng khí NO là sản phẩm khử duy nhất của N+5, các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với A. 55,1. B. 58,6. C. 50,4. D. 64,6. Câu 30: Cho các nhận định sau: (a) Fe và Cr đều có tính nhiễm từ. (b) Fe và Cr đều tác dụng với dung dịch HCl loãng. (c) Hỗn hợp gồm Cu và FeCl3 có tỉ lệ mol 1:1 tan hết trong dung dịch HCl loãng, dư. (d) Các kim loại có nguyên tử khối lớn hơn nước thì nặng hơn nước. Số nhận định đúng là A. 3. B. 2. C. 4. D. 1. ------------ HẾT ----------
ĐỀ KIỂM TRA HỌC KỲ II - LỚP 12 ĐỀ THAM KHẢO SỐ 04 Cho H=1; C=12; N=14; O=16; S= 32; Li=7; Na=23; K=39; Cs=133; Al=27; Cu=64; Fe=56; Zn= 65; Cr=52; Ba=137. Học sinh được dùng bảng tuần hoàn, bảng tính tan và máy tính cầm tay theo quy định. Câu 1: Sản phẩm của phản ứng nhiệt nhôm luôn có A. Al. B. Al(OH)3. C. Al2O3 D. O2. Câu 2: Chất nào sau đây vừa tác dụng với dung dịch HCl vừa tác dụng với dung dịch AgNO3? A. Cu. B. Al2O3. C. FeO. D. Fe(NO3)2. Câu 3: Để phân biệt dung dịch BaCl2 với dung dịch NaCl, người ta dùng dung dịch A. HNO3. B. Na2CO3. C. NaNO3. D. KNO3. Câu 4: Chất nào sau đây không có tính chất lưỡng tính? A. Cr(OH)3. B. CrO3. C. Al2O3. D. Al(OH)3. Câu 5: Thêm dung dịch NaOH dư vào dung dịch chứa 0,3 mol Fe(NO3)3. Lọc kết tủa, đem nung đến khối lượng không đổi thì khối lượng chất rắn thu được là: A. 96,0 gam. B. 24,0 gam. C. 32,1 gam. D. 48,0 gam. Câu 6: Một mẫu kim loại Ag có lẫn Cu, Fe. Để loại bỏ tạp chất của mẫu Ag trên người ta dung dịch nào sau đây? A. FeCl3. B. HNO3. C. HCl. D. CuCl2. Câu 7: Để loại bỏ lớp cặn trong ấm đun sôi nước lâu ngày, người ta có thể dùng dung dịch nào sau đây? A. Giấm ăn. B. Nước vôi. C. Cồn 700. D. Muối ăn. Câu 8: Trong 4 chất rắn: Al, Al2O3, Al(OH)3, AlCl3; số chất phản ứng được với dung dịch NaOH là A. 3. B. 1. C. 4. D. 2. Câu 9: Sục 6,72 lít khí CO2 (đktc) vào dung dịch có chứa 0,25 mol Ca(OH)2. Kết thúc phản ứng khối lượng kết tủa thu được là A. 15 gam. B. 25 gam. C. 20 gam. D. 30 gam. Câu 10: Phát biểu nào sau đây không đúng? A. Nhôm là kim loại nhẹ, dẫn điện, dẫn nhiệt tốt. B. Nhôm bị phá hủy trong môi trường kiềm. C. Nhôm có tính khử mạnh chỉ sau kim loại kiềm và kiềm thổ trong cùng chu kì. D. Nhôm phản ứng được với H2SO4 đặc nguội. Câu 11: Cho Fe dư vào dung dịch H2SO4 loãng thu được 6,72 lít khí ở điều kiện tiêu chuẩn. Khối lượng sắt tham gia phản ứng là A. 16,8 gam. B. 5,6 gam. C. 25,2 gam. D. 11,2 gam. Câu 12: Trong công nghiệp, quặng boxit dùng để điều chế kim loại nào sau đây? A. Ba. B. Cu. C. Al. D. Mg. Câu 13: Cho hỗn hợp gồm 0,1 mol Ba và 0,3 mol Al vào nước dư. Thể tích H2 thu được (ở đktc) là A. 4,48 lít. B. 2,24 lít. C. 6,72 lít. D. 8,96 lít. Câu 14: Trong công nghiệp sản suất gang, chất nào sau đây dùng để khử oxit ở nhiệt độ cao? A. H2. B. Al. C. CO. D. Na. Câu 15: Oxit nào sau đây bị oxi hóa khi phản ứng với dung dịch HNO3 loãng? A. CuO. B. MgO. C. Al2O3. D. Fe3O4. Câu 16: Kim loại sắt tác dụng với chất nào sau đây tạo ra muối sắt (II)? A. H2SO4 đặc nóng, dư. B. CuSO4. C. MgSO4. D. HNO3 đặc, nóng, dư. Câu 17: Nguyên tố hóa học nào sau đây thuộc nhóm kim loại kiềm thổ? A. Nhôm. B. Magie. C. Natri. D. Kali. Câu 18: Phản ứng nào sau đây không đúng? A. Cr(OH)2 + 2NaOH → Na2CrO2 + 2H2O (hay Na2[Cr(OH)4] B. 2Cr + 3Cl2 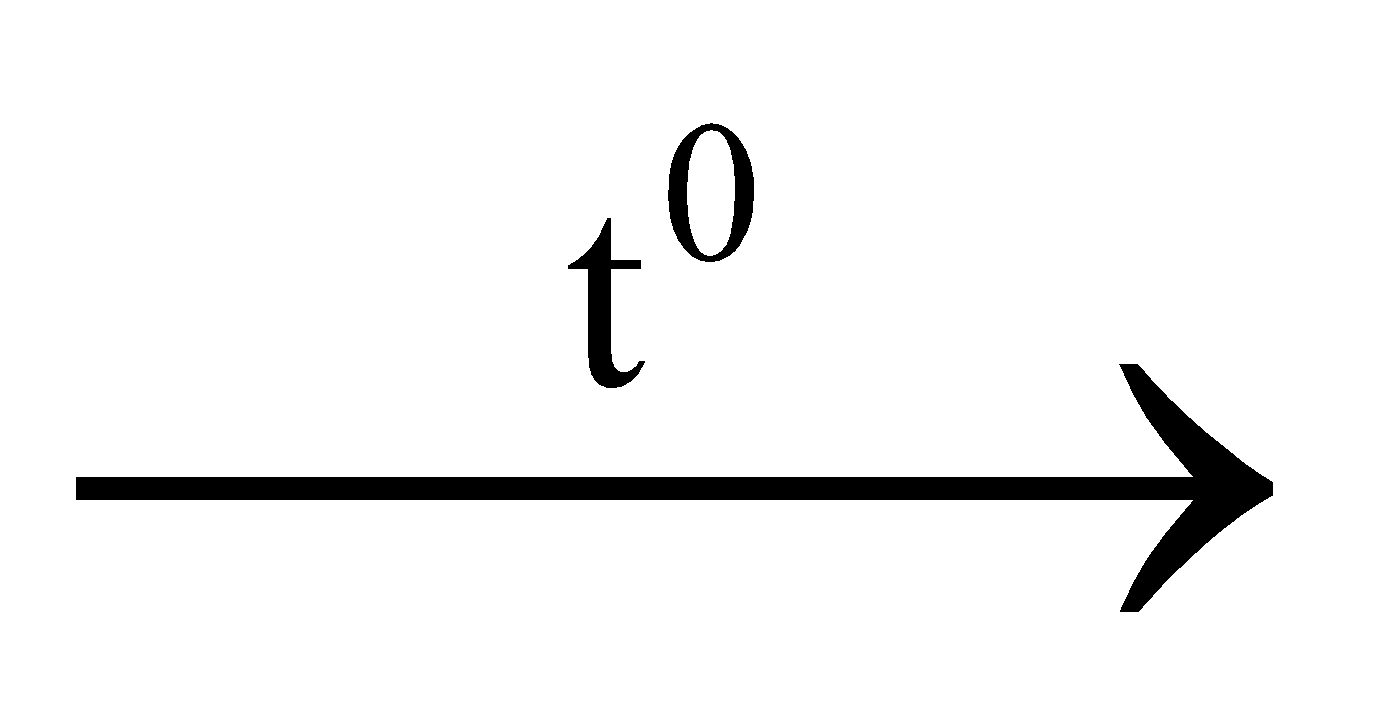 2CrCl3 2CrCl3 C. 2Cr + 3S 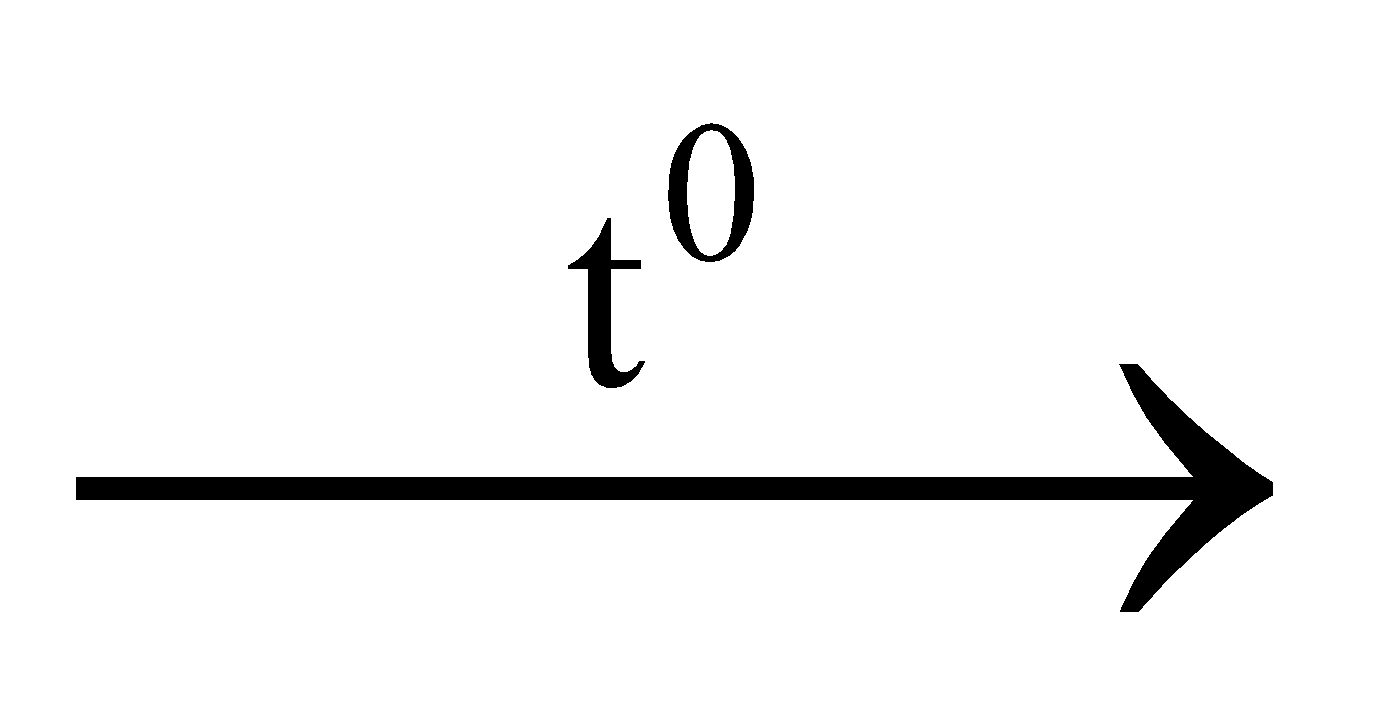 Cr2S3 Cr2S3 D. 2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O Câu 19: Đốt cháy bột crom trong oxi dư thu được 2,28 gam một oxit duy nhất. Khối lượng crom bị đốt cháy là A. 0,78 gam. B. 1,19 gam. C. 1,74 gam. D. 1,56 gam. Câu 20: Cho một lượng hỗn hợp CuO và Fe2O3 hòa tan hết trong dung dịch HCl thu được 2 muối có tỉ lệ mol là 1:1. Phần trăm khối lượng của Fe2O3 có trong hỗn hợp là A. 50%. B. 40%. C. 60%. D. 70%. Câu 21: Có các kim loại sau: Ni, Zn, Sn, Cu. Trong thực tế kim loại nào được dùng để bảo vệ điện hóa vỏ tàu biển? A. Zn. B. Sn. C. Cu. D. Ni. Câu 22: Cho 20 gam hỗn hợp Mg và BaO tác dụng với dung dịch HCl dư thu được 3,808 lít khí H2 (ở đktc). Thành phần % khối lượng của BaO có trong hỗn hợp là A. 89,8%. B. 36,2%. C. 20,4%. D. 79,6%. Câu 23: Nhỏ từ từ dung dịch NaOH đến dư vào dung dịch X. Sau khi các phản ứng xảy ra hoàn toàn chỉ thu được dung dịch trong suốt. Chất tan có trong dung dịch X là A. Fe(NO3)3. B. CuSO4. C. AlCl3. D. Ca(HCO3)2. Câu 24: Hòa tan 27,2 gam hỗn hợp Fe và FeO vào dung dịch H2SO4 loãng, sau đó làm bay hơi dung dịch người ta thu được 111,2 gam chất rắn FeSO4.7H2O. Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là A. 20,6%. B. 25%. C. 60%. D. 50%. Câu 25: Nhúng thanh sắt có khối lượng 56 gam vào 200 ml dung dịch CuSO4. Khi phản ứng xong lấy thanh sắt đem cân thấy nặng 56,4 gam. Nồng độ mol/l dung dịch CuSO4 đã dùng là A. 0,5 M. B. 0,25 M. C. 0,75 M. D. 1,0 M.
Câu 26: Nhận định nào sau đây không đúng? A. Al(OH)3 tan được trong dung dịch HCl và dung dịch NaOH. B. Al2O3 là hợp chất bền bởi nhiệt. C. Al3+ bị khử bởi Zn. D. Al khử được Cu2+. Câu 27: Phát biểu nào sau đây không đúng? A. NaOH dùng để nấu xà phòng. B. Na2CO3 dùng trong công nghiệp nấu thủy tinh, phẩm nhuộm. C. CaCO3 dùng để nặn tượng, đúc khuôn và bó bột khi gẫy xương. D. NaHCO3 dùng trong công nghiệm thực phẩm. Câu 28: Dung dịch NaOH có thể tác dụng với tất cả các chất nào sau đây? A. Al, HCl, CaCO3. B. FeCl3, HCl, Ca(OH)2. C. FeCl2, Al(OH)3, HCl. D. CuSO4, Ba(OH)2, H2SO4. Câu 29: Để khử hoàn toàn 30 gam hỗn hợp gồm CuO, Fe2O3, Fe, MgO cần dùng 5,6 lít khí CO (đktc). Khối lượng chất rắn thu được là A. 28 gam. B. 26 gam. C. 24 gam. D. 22 gam. Câu 30: Cho dung dịch NaOH (dư) vào dung dịch chứa hỗn hợp MgCl2 và AlCl3, thu được kết tủa X. Nung X trong không khí đến khối lượng không đổi thu được chất rắn Y. Chất rắn Y là A. Cr2O3. B. CrO. C. MgO và Cr2O3. D. MgO.
ĐỀ CƯƠNG ÔN THI HÓA 12 HỌC KỲ II
TÍNH CHẤT CỦA KIM LOẠI – DÃY ĐIỆN HÓA CỦA KIM LOẠI
Câu 13: Kim loại nào sau đây có tính dẫn điện tốt nhất trong tất cả các kim loại? A. Vàng. B. Bạc. C. Đồng. D. Nhôm. Câu 14: Kim loại nào sau đây dẻo nhất trong tất cả các kim loại? A. Vàng. B. Bạc. C. Đồng. D. Nhôm. Câu 15: Kim loại nào sau đây có độ cứng lớn nhất trong tất cả các kim loại? A. Vonfam. B. Crom C. Sắt D. Đồng Câu 16: Kim loại nào sau đây là kim loại mềm nhất trong tất cả các kim loại ? A. Liti. B. Xesi. C. Natri. D. Kali. Câu 17: Kim loại nào sau đây có nhiệt độ nóng chảy cao nhất trong tất cả các kim loại? A. Vonfam. B. Sắt. C. Đồng. D. Kẽm. Câu 18: Kim loại nào sau đây nhẹ nhất ( có khối lượng riêng nhỏ nhất ) trong tất cả các kim loại ? A. Natri B. Liti C. Kali D. Rubidi Câu 19: Tính chất hóa học đặc trưng của kim loại là A. tính bazơ. B. tính oxi hóa. C. tính axit. D. tính khử. Câu 20: Hai kim loại đều phản ứng với dung dịch Cu(NO3)2 giải phóng kim loại Cu là A. Al và Fe. B. Fe và Au. C. Al và Ag. D. Fe và Ag. Câu 21: Cặp chất không xảy ra phản ứng là A. Fe + Cu(NO3)2. B. Cu + AgNO3. C. Zn + Fe(NO3)2. D. Ag + Cu(NO3)2. Câu 22: Hai kim loại Al và Cu đều phản ứng được với dung dịch A. NaCl loãng. B. H2SO4 loãng. C. HNO3 loãng. D. NaOH loãng Câu 23: Kim loại Cu phản ứng được với dung dịch A. FeSO4. B. AgNO3. C. KNO3. D. HCl. Câu 24: Dung dịch FeSO4 và dung dịch CuSO4 đều tác dụng được với A. Ag. B. Fe. C. Cu. D. Zn. Câu 25: Để hoà tan hoàn toàn hỗn hợp gồm hai kim loại Cu và Zn, ta có thể dùng một lượng dư dung dịch A. HCl. B. AlCl3. C. AgNO3. D. CuSO4. Câu 26: Hai dung dịch đều tác dụng được với Fe là A. CuSO4 và HCl. B. CuSO4 và ZnCl2. C. HCl và CaCl2. D. MgCl2 và FeCl3. Câu 27: Cho các kim loại: Ni, Fe, Cu, Zn; số kim loại tác dụng với dung dịch Pb(NO3)2 là A. 1. B. 2. C. 3. D. 4. Câu 28: Dung dịch muối nào sau đây tác dụng được với cả Ni và Pb? A. Pb(NO3)2. B. Cu(NO3)2. C. Fe(NO3)2. D. Ni(NO3)2. Câu 29: Tất cả các kim loại Fe, Zn, Cu, Ag đều tác dụng được với dung dịch A. HCl. B. H2SO4 loãng. C. HNO3 loãng. D. KOH. Câu 30: Cho các kim loại: Na, Mg, Fe, Al; kim loại có tính khử mạnh nhất là A. Al. B. Na. C. Mg. D. Fe. Câu 31: Cho phản ứng: aAl + bHNO3  cAl(NO3)3 + dNO + eH2O. cAl(NO3)3 + dNO + eH2O. Hệ số a, b, c, d, e là các số nguyên, tối giản. Tổng (a + b) bằng A. 5. B. 4. C. 7. D. 6. Câu 32: Dãy nào sau đây chỉ gồm các chất vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch AgNO3 ? A. Zn, Cu, Mg B. Al, Fe, CuO C. Fe, Ni, Sn D. Hg, Na, Ca Câu 33: Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra A. sự khử Fe2+ và sự oxi hóa Cu. B. sự khử Fe2+ và sự khử Cu2+. C. sự oxi hóa Fe và sự oxi hóa Cu. D. sự oxi hóa Fe và sự khử Cu2+. Câu 34: Cặp chất không xảy ra phản ứng hoá học là A. Cu + dung dịch FeCl3. B. Fe + dung dịch HCl. C. Fe + dung dịch FeCl3. D. Cu + dung dịch FeCl2. Câu 35: Cho kim loại M tác dụng với Cl2 được muối X; cho kim loại M tác dụng với dung dịch HCl được muối Y. Nếu cho kim loại M tác dụng với dung dịch muối X ta cũng được muối Y. Kim loại M có thể là A. Mg B. Al C. Zn D. Fe Câu 36: Để khử ion Cu2+ trong dung dịch CuSO4 có thể dùng kim loại A. K B. Na C. Ba D. Fe Câu 37: Để khử ion Fe3+ trong dung dịch thành ion Fe2+ có thể dùng một lượng dư A. Kim loại Mg B. Kim loại Ba C. Kim loại Cu D. Kim loại Ag Câu 38: Thứ tự một số cặp oxi hóa - khử trong dãy điện hóa như sau : Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+. Cặp chất không phản ứng với nhau là A. Cu và dung dịch FeCl3 B. Fe và dung dịch CuCl2 C. Fe và dung dịch FeCl3 D. dung dịch FeCl2 và dung dịch CuCl2 Câu 39: X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag) A. Fe, Cu. B. Cu, Fe. C. Ag, Mg. D. Mg, Ag. Câu 40: Dãy gồm các kim loại được xếp theo thứ tự tính khử tăng dần từ trái sang phải là A. Mg, Fe, Al. B. Fe, Mg, Al. C. Fe, Al, Mg. D. Al, Mg, Fe. Câu 41: Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là A. Na, Ba, K. B. Be, Na, Ca. C. Na, Fe, K. D. Na, Cr, K. Câu 42: Trong dung dịch CuSO4, ion Cu2+ không bị khử bởi kim loại A. Fe. B. Ag. C. Mg. D. Zn. Câu 43: Cho dãy các kim loại: Fe, Na, K, Ca. Số kim loại trong dãy tác dụng được với nước ở nhiệt độ thường là A. 4. B. 1. C. 3. D. 2. Câu 44: Kim loại phản ứng được với dung dịch H2SO4 loãng là A. Ag. B. Au. C. Cu. D. Al. Câu 45: Cho dãy các kim loại: Na, Cu, Fe, Ag, Zn. Số kim loại trong dãy phản ứng được với dung dịch HCl là A. 5. B. 2. C. 3. D. 4. Câu 46: Đồng (Cu) tác dụng được với dung dịch A. H2SO4 đặc, nóng. B. H2SO4 loãng. C. FeSO4. D. HCl. Câu 47: Cho dãy các kim loại: Na, Cu, Fe, Zn. Số kim loại trong dãy phản ứng được với dung dịch HCl là A. 3. B. 1. C. 4. D. 2. Câu 48: Cho dãy các kim loại: K, Mg, Na, Al. Kim loại có tính khử mạnh nhất trong dãy là A. Na. B. Mg. C. Al. D. K. SỰ ĂN MÒN KIM LOẠI Câu 49: Một số hoá chất được để trên ngăn tủ có khung bằng kim loại. Sau 1 thời gian, người ta thấy khung kim loại bị gỉ. Hoá chất nào dưới đây có khả năng gây ra hiện tượng trên? A. Ancol etylic. B. Dây nhôm. C. Dầu hoả. D. Axit clohydric. Câu 50: Biết rằng ion Pb2+ trong dung dịch oxi hóa được Sn. Khi nhúng hai thanh kim loại Pb và Sn được nối với nhau bằng dây dẫn điện vào một dung dịch chất điện li thì A. cả Pb và Sn đều bị ăn mòn điện hoá. B. cả Pb và Sn đều không bị ăn mòn điện hoá. C. chỉ có Pb bị ăn mòn điện hoá. D. chỉ có Sn bị ăn mòn điện hoá. Câu 51: Cho các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau : Fe và Pb; Fe và Zn; Fe và Sn; Fe và Ni. Khi nhúng các cặp kim loại trên vào dung dịch axit, số cặp kim loại trong đó Fe bị phá hủy trước là A. 4 B. 1 C. 2 D. 3 Câu 52: Khi để lâu trong không khí ẩm một vật bằng sắt tây (sắt tráng thiếc) bị sây sát sâu tới lớp sắt bên trong, sẽ xảy ra quá trình: A. Sn bị ăn mòn điện hóa. B. Fe bị ăn mòn điện hóa. C. Fe bị ăn mòn hóa học. D. Sn bị ăn mòn hóa học. Câu 53: Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại A. Cu. B. Zn. C. Sn. D. Pb. Câu 54: Có 4 dung dịch riêng biệt: a) HCl, b) CuCl2, c) FeCl3, d) HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh Fe nguyên chất. Số trường hợp xuất hiện ăn mòn điện hoá là A. 0. B. 1. C. 2. D. 3. Câu 55: Cho các hợp kim sau: Cu-Fe (I); Zn-Fe (II); Fe-C (III); Sn-Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là: A. I, II và III. B. I, II và IV. C. I, III và IV. D. II, III và IV. ĐIỀU CHẾ KIM LOẠI Câu 56: Khi điều chế kim loại, các ion kim loại đóng vai trò là chất A. bị khử. B. nhận proton. C. bị oxi hoá. D. cho proton. Câu 57: Để loại bỏ kim loại Cu ra khỏi hỗn hợp bột gồm Ag và Cu, người ta ngâm hỗn hợp kim loại trên vào lượng dư dung dịch A. AgNO3. B. HNO3. C. Cu(NO3)2. D. Fe(NO3)2. Câu 58: Chất không khử được sắt oxit (ở nhiệt độ cao) là A. Cu. B. Al. C. CO. D. H2. Câu 59: Hai kim loại có thể điều chế bằng phương pháp nhiệt luyện là A. Ca và Fe. B. Mg và Zn. C. Na và Cu. D. Fe và Cu. Câu 60: Phương pháp thích hợp điều chế kim loại Ca từ CaCl2 là A. nhiệt phân CaCl2. B. điện phân CaCl2 nóng chảy. C. dùng Na khử Ca2+ trong dung dịch CaCl2. D. điện phân dung dịch CaCl2. Câu 61: Oxit dễ bị H2 khử ở nhiệt độ cao tạo thành kim loại là A. Na2O. B. CaO. C. CuO. D. K2O. Câu 62: Phương trình hoá học nào sau đây thể hiện cách điều chế Cu theo phương pháp thuỷ luyện ? A. Zn + CuSO4 → Cu + ZnSO4 B. H2 + CuO → Cu + H2O C. CuCl2 → Cu + Cl2 D. 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2 Câu 63: Phương trình hóa học nào sau đây biểu diễn cách điều chế Ag từ AgNO3 theo phương pháp thuỷ luyện ? A. 2AgNO3 + Zn → 2Ag + Zn(NO3)2 B. 2AgNO3 → 2Ag + 2NO2 + O2 C. 4AgNO3 + 2H2O → 4Ag + 4HNO3 + O2 D. Ag2O + CO → 2Ag + CO2. Câu 64: Trong phương pháp thuỷ luyện, để điều chế Cu từ dung dịch CuSO4 có thể dùng kim loại nào làm chất khử? A. K. B. Ca. C. Zn. D. Ag. Câu 65: Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm A. Cu, Al, Mg. B. Cu, Al, MgO. C. Cu, Al2O3, Mg. D. Cu, Al2O3, MgO. Câu 66: Cho luồng khí H2 (dư) qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung ở nhiệt độ cao. Sau phản ứng hỗn hợp rắn còn lại là: A. Cu, FeO, ZnO, MgO. B. Cu, Fe, Zn, Mg. C. Cu, Fe, Zn, MgO. D. Cu, Fe, ZnO, MgO. Câu 67: Hai kim loại có thể được điều chế bằng phương pháp điện phân dung dịch là A. Al và Mg. B. Na và Fe. C. Cu và Ag. D. Mg và Zn. Câu 68: Cặp chất không xảy ra phản ứng hoá học là A. Cu + dung dịch FeCl3. B. Fe + dung dịch HCl. C. Fe + dung dịch FeCl3. D. Cu + dung dịch FeCl2. Câu 69: Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung dịch muối của chúng là: A. Ba, Ag, Au. B. Fe, Cu, Ag. C. Al, Fe, Cr. D. Mg, Zn, Cu. Câu 70: Hai kim loại có thể được điều chế bằng phương pháp điện phân dung dịch là A. Al và Mg. B. Na và Fe. C. Cu và Ag. D. Mg và Zn. Câu 71: Khi điện phân NaCl nóng chảy (điện cực trơ), tại catôt xảy ra A. sự khử ion Cl-. B. sự oxi hoá ion Cl-. C. sự oxi hoá ion Na+. D. sự khử ion Na+. Câu 72: Oxit dễ bị H2 khử ở nhiệt độ cao tạo thành kim loại là A. Na2O. B. CaO. C. CuO. D. K2O. Câu 73: Trong công nghiệp, kim loại được điều chế bằng phương pháp điện phân hợp chất nóng chảy của kim loại đó là A. Na. B. Ag. C. Fe. D. Cu. Câu 74: Phương pháp thích hợp điều chế kim loại Mg từ MgCl2 là A. điện phân dung dịch MgCl2. B. điện phân MgCl2 nóng chảy. C. nhiệt phân MgCl2. D. dùng K khử Mg2+ trong dung dịch MgCl2. �CÁC DẠNG BÀI TẬP PHẦN ĐẠI CƯƠNG KIM LOẠI DẠNG 1: KIM LOẠI TÁC DỤNG VỚI PHI KIM Câu 1. Bao nhiêu gam clo tác dụng vừa đủ kim loại nhôm tạo ra 26,7 gam AlCl3? A. 21,3 gam B. 12,3 gam. C. 13,2 gam. D. 23,1 gam. Câu 2: Đốt cháy bột Al trong bình khí Clo dư, sau khi phản ứng xảy ra hoàn toàn khối lượng chất rắn trong bình tăng 4,26 gam. Khối lượng Al đã phản ứng là A. 1,08 gam. B. 2,16 gam. C. 1,62 gam. D. 3,24 gam. Câu 3. Bao nhiêu gam Cu tác dụng vừa đủ với clo tạo ra 27 gam CuCl2? A. 12,4 gam B. 12,8 gam. C. 6,4 gam. D. 25,6 gam. Câu 4. Cho m gam 3 kim loại Fe, Al, Cu vào một bình kín chứa 0,9 mol oxi. Nung nóng bình 1 thời gian cho đến khi số mol O2 trong bình chỉ còn 0,865 mol và chất rắn trong bình có khối lượng 2,12 gam. Giá trị m đã dùng là: A. 1,2 gam. B. 0,2 gam. C. 0,1 gam. D. ,0 gam. Câu 5: Đốt 1 lượng nhôm(Al) trong 6,72 lít O2. Chất rắn thu được sau phản ứng cho hoà tan hoàn toàn vào dung dịch HCl thấy bay ra 6,72 lít H2 (các thể tích khí đo ở đkc). Khối lượng nhôm đã dùng là A. 8,1gam. B. 16,2gam. C. 18,4gam. D. 24,3gam.
DẠNG 2: KIM LOẠI TÁC DỤNG VỚI DUNG DỊCH AXIT
Câu 1. Cho 10 gam hỗn hợp các kim loại Mg và Cu tác dụng hết với dung dịch HCl loãng dư thu được 3,733 lit H2(đkc). Thành phần % của Mg trong hỗn hợp là: A. 50%. B. 35%. C. 20%. D. 40%. Câu 2. Một hỗn hợp gồm 13 gam kẽm và 5,6 gam sắt tác dụng với dung dịch axit sunfuric loãng dư. Thể tích khí hidro (đktc) được giải phóng sau phản ứng là. A. 2,24 lit. B. 4,48 lit. C. 6,72 lit. D. 67,2 lit. Câu 3. Cho 4,05 gam Al tan hết trong dung dịch HNO3 thu V lít N2O (đkc) duy nhất. Giá trị V là A. 2,52 lít. B. 3,36 lít. C. 4,48 lít. D. 1,26 lít. Câu 4: Hỗn hợp X gồm Fe và Cu, trong đó Cu chiếm 43,24% khối lượng. Cho 14,8 gam X tác dụng hết với dung dịch HCl thấy có V lít khí (đktc) bay ra. Giá trị của V là A. 1,12 lít. B. 3,36 lít. C. 2,24 lít. D. 4,48 lít. Câu 5: Hoà tan hoàn toàn 1,5 gam hỗn hợp bột Al và Mg vào dung dịch HCl thu được 1,68 lít H2 (đkc). Phần % khối lượng của Al trong hỗn hợp là A. 60%. B. 40%. C. 30%. D. 80%. Câu 6: Hoà tan m gam Fe trong dung dịch HCl dư, sau khi phản ứng kết thúc thu được 4,48 lít khí H2 (ở đktc). Giá trị của m là (Cho Fe = 56, H = 1, Cl = 35,5) A. 2,8. B. 1,4. C. 5,6. D. 11,2. Câu 7: Hòa tan 6,5 gam Zn trong dung dịch axit HCl dư, sau phản ứng cô cạn dung dịch thì số gam muối khan thu được là (Cho H = 1, Zn = 65, Cl = 35,5) A. 20,7 gam. B. 13,6 gam. C. 14,96 gam. D. 27,2 gam. Câu 8: Hoà tan 6,4 gam Cu bằng axit H2SO4 đặc, nóng (dư), sinh ra V lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của V là A. 4,48. B. 6,72. C. 3,36. D. 2,24. Câu 9: Hoà tan m gam Al bằng dung dịch HCl (dư), thu được 3,36 lít H2 (ở đktc). Giá trị của m là A. 4,05. B. 2,70. C. 5,40. D. 1,35. Câu 10: Hoà tan 5,6 gam Fe bằng dung dịch HNO3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là A. 6,72. B. 4,48. C. 2,24. D. 3,36. Câu 11: Cho 10 gam hỗn hợp gồm Fe và Cu tác dụng với dung dịch H2SO4 loãng (dư). Sau phản ứng thu được 2,24 lít khí hiđro (ở đktc), dung dịch X và m gam chất rắn không tan. Giá trị của m là (Cho H = 1, Fe = 56, Cu = 64) A. 6,4 gam. B. 3,4 gam. C. 5,6 gam. D. 4,4 gam. Câu 12: Cho 20 gam hỗn hợp bột Mg và Fe tác dụng hết với dung dịch HCl thấy có 1 gam khí H2 bay ra. Lượng muối clorua tạo ra trong dung dịch là bao nhiêu gam ? A. 40,5g. B. 45,5g. C. 55,5g. D. 60,5g. Câu 13: Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch HCl (dư), sau khi kết thúc phản ứng sinh ra 3,36 lít khí (ở đktc). Nếu cho m gam hỗn hợp X trên vào một lượng dư axit nitric (đặc, nguội), sau khi kết thúc phản ứng sinh ra 6,72 lít khí NO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là A. 15,6. B. 10,5. C. 11,5. D. 12,3. Câu 14: Trong hợp kim Al – Mg, cứ có 9 mol Al thì có 1 mol Mg. Thành phần phần % khối lượng của hợp kim là A. 80% Al và 20% Mg. B. 81% Al và 19% Mg. C. 91% Al và 9% Mg. D. 83% Al và 17% Mg. Câu 15: Hoà tan 6 gam hợp kim Cu, Fe và Al trong axit HCl dư thấy thoát ra 3,024 lít khí (đkc) và 1,86 gam chất rắn không tan. Thành phần phần % của hợp kim là A. 40% Fe, 28% Al 32% Cu. B. 41% Fe, 29% Al, 30% Cu. C. 42% Fe, 27% Al, 31% Cu. D. 43% Fe, 26% Al, 31% Cu. Câu 16. Hoà tan hoàn toàn 7,8 gam hỗn hợp gồm Mg, Al trong dung dịch HCl dư thấy tạo ra 8,96 lít khí H2 (đkc). Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là A. 18,1 gam. B. 36,2 gam. C. 54,3 gam. D. 63,2 gam. 0 Câu 8: Ngâm một lá Fe trong dung dịch CuSO4. Sau một thời gian phản ứng lấy lá Fe ra rửa nhẹ làm khô, đem cân thấy khối lượng tăng thêm 1,6 gam. Khối lượng Cu bám trên lá Fe là bao nhiêu gam? A. 12,8 gam. B. 8,2 gam. C. 6,4 gam. D. 9,6 gam. Câu 8. Cho dòng khí CO dư đi qua hỗn hợp (X) chứa 31,9 gam gồm Al2O3, ZnO, FeO và CaO thì thu được 28,7 gam hỗn hợp chất rắn (Y). Cho toàn bộ hỗn hợp chất rắn (Y) tác dụng với dung dịch HCl dư thu được V lít H2 (đkc). Giá trị V là A. 5,60 lít. B. 4,48 lít. C. 6,72 lít. D. 2,24 lít. Câu 1. Khi cho dòng điện một chiều I=2A qua dung dịch CuCl2 trong 10 phút. Khối lượng đồng thoát ra ở catod là A. 40 gam. B. 0,4 gam. C. 0,2 gam. D. 4 gam. Câu 3. Điện phân dùng điện cực trơ dung dịch muối sunfat kim loại hoá trị 2 với cường độ dòng điện 3A. Sau 1930 giây thấy khối lượng catot tăng 1,92 gam. Muối sunfat đã điện phân là A. CuSO4. B. NiSO4. C. MgSO4. D. ZnSO4 . Câu 18. Cho m gam Fe vào dung dịch HNO3 lấy dư ta thu được 8,96 lit(đkc) hỗn hợp khí X gồm 2 khí NO và NO2 có tỉ khối hơi hỗn hợp X so với oxi bằng 1,3125. Giá trị của m là A. 0,56 gam. B. 1,12 gam. C. 11,2 gam. D. 5,6 gam. Câu 19. Cho 60 gam hỗn hợp Cu và CuO tan hết trong dung dịch HNO3 loãng dư thu được 13,44 lit khí NO (đkc, sản phẩm khử duy nhất). Phần % về khối lượng của Cu trong hỗn hợp là: A. 69%. B. 96%. C. 44% D. 56%. 0 Câu 8: Ngâm một lá Fe trong dung dịch CuSO4. Sau một thời gian phản ứng lấy lá Fe ra rửa nhẹ làm khô, đem cân thấy khối lượng tăng thêm 1,6 gam. Khối lượng Cu bám trên lá Fe là bao nhiêu gam? A. 12,8 gam. B. 8,2 gam. C. 6,4 gam. D. 9,6 gam. Câu 8. Cho dòng khí CO dư đi qua hỗn hợp (X) chứa 31,9 gam gồm Al2O3, ZnO, FeO và CaO thì thu được 28,7 gam hỗn hợp chất rắn (Y). Cho toàn bộ hỗn hợp chất rắn (Y) tác dụng với dung dịch HCl dư thu được V lít H2 (đkc). Giá trị V là A. 5,60 lít. B. 4,48 lít. C. 6,72 lít. D. 2,24 lít. Câu 1. Khi cho dòng điện một chiều I=2A qua dung dịch CuCl2 trong 10 phút. Khối lượng đồng thoát ra ở catod là A. 40 gam. B. 0,4 gam. C. 0,2 gam. D. 4 gam. Câu 3. Điện phân dùng điện cực trơ dung dịch muối sunfat kim loại hoá trị 2 với cường độ dòng điện 3A. Sau 1930 giây thấy khối lượng catot tăng 1,92 gam. Muối sunfat đã điện phân là A. CuSO4. B. NiSO4. C. MgSO4. D. ZnSO4 Câu 21. Cho 8,3 gam hỗn hợp Al và Fe tác dụng với dung dịch HNO3 loãng dư thì thu được 45,5 gam muối nitrat khan. Thể tích khí NO (đktc, sản phẩm khử duy nhất) thoát ra là: A. 4,48 lít. B. 6,72 lít. C. 2,24 lít. D. 3,36 lít. Câu 22. Cho 1,86 gam hỗn hợp Al và Mg tác dụng với dung dịch HNO3 loãng dư thì thu được 560 ml lít khí N2O (đktc, sản phẩm khử duy nhất) bay ra. Khối lượng muối nitrat tạo ra trong dung dịch là: A. 40,5 gam. B. 14,62 gam. C. 24,16 gam. D. 14,26 gam. Câu 23. Cho 5 gam hỗn hợp bột Cu và Al vào dung dịch HCl dư thu 3,36 lít H2 ở đktc. Phần trăm Al theo khối lượng ở hỗn hợp đầu là A. 27%. B. 51%. C. 64%. D. 54%. Câu 24: Hoà tan hoàn toàn 1,23 gam hỗn hợp X gồm Cu và Al vào dung dịch HNO3 đặc, nóng thu được 1,344 lít khí NO2 (sản phẩm khử duy nhất, ở đktc). Phần trăm về khối lượng của Cu trong hỗn hợp X là A. 21,95%. B. 78,05%. C. 68,05%. D. 29,15%. Câu 25. Cho a gam bột Al tác dụng vừa đủ với dung dịch HNO3 loãng thu được dung dịch A chỉ chứa một muối duy nhất và 0,1792 lít (đktc) hỗn hợp khí NO, N2 có tỉ khối hơi so H2 là 14,25. Tính a ? A. 0,459 gam. B. 0,594 gam. C. 5,94 gam. D. 0,954 gam. Câu 26. Hoà tan hoàn toàn 7,8 gam hỗn hợp gồm Mg, Al trong dung dịch HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng thêm 7 gam. Khối lượng của Al có trong hỗn hợp ban đầu là A. 2,7 gam. B. 5,4 gam. C. 4,5 gam. D. 2,4 gam. Câu 27: Cho hỗn hợp A gồm Cu và Mg vào dung dịch HCl dư thu được 5,6 lít khí (đkc) không màu và một chất rắn không tan B. Dùng dung dịch H2SO4 đặc, nóng để hoà tan chất rắn B thu được 2,24 lít khí SO2 (đkc). Khối lượng hỗn hợp A ban đầu là: A. 6,4 gam. B. 12,4 gam. C. 6,0 gam. D. 8,0 gam. Câu 28: Hoà tan hoàn toàn 1,5 gam hỗn hợp bột Al và Mg vào dung dịch HCl thu được 1,68 lít H2 (đkc). Phần % khối lượng của Al trong hỗn hợp là A. 60%. B. 40%. C. 30%. D. 80%. DẠNG 3 : XÁC ĐỊNH CÔNG THỨC Câu 1. Hoà tan 2,52 gam một kim loại bằng dung dịch H2SO4 loãng dư, cô cạn dung dịch thu được 6,84 gam muối khan. Kim loại đó là: A. Mg. B. Al. C. Zn. D. Fe. Câu 2. Hoà tan hết m gam kim loại M bằng dung dịch H2SO4 loãng, rồi cô cạn dung dịch sau phản ứng thu được 5m gam muối khan. Kim loại M là: A. Al. B. Mg. C. Zn. D. Fe. Câu 3: Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thu được 336 ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Kim loại đó là A. Zn. B. Fe. C. Ni. D. Al. Câu 4. Nhiệt phân hoàn toàn 3,5 gam một muối cacbonat kim loại hoá trị 2 thu được 1,96 gam chất rắn. Muối cacbonat của kim loại đã dùng là: A. FeCO3. B. BaCO3. C. MgCO3. D. CaCO3. Câu 5. Hoà tan hoàn toàn 0,575 gam một kim loại kìềm vào nước. Để trung hoà dung dịch thu được cần 25 gam dung dịch HCl 3,65%. Kim loại hoà tan là: A. Li. B. K. C. Na. D. Rb. Câu 6. Cho 9,1 gam hỗn hợp hai muối cacbonat trung hoà của 2 kim loại kiềm ở 2 chu kỳ liên tiếp tan hoàn toàn trong dung dịch HCl dư thu được 2,24 lít CO2(đktc). Hai kim loại đó là: A. K và Cs. B. Na và K. C. Li và Na. D. Rb và Cs. Câu 7. Hoà tan 1,3 gam một kim loại M trong 100 ml dung dịch H2SO4 0,3M. Để trung hoà lượng axit dư cần 200 ml dung dịch NaOH 0,1M. Xác định kim loại M? A. Al. B. Fe. C. Zn. D. Mg. Câu 8. Lượng khí clo sinh ra khi cho dung dịch HCl đặc dư tác dụng với 6,96 gam MnO2 đã oxi hoá kim loại M (thuộc nhóm IIA), tạo ra 7,6 gam muối khan. Kim loại M là: A. Ba. B. Mg. C. Ca. D. Be. Câu 9. Hoà tan hoàn toàn 2 gam kim loại thuộc nhóm IIA vào dung dịch HCl và sau đó cô cạn dung dịch người ta thu được 5,55 gam muối khan. Kim loại nhóm IIA là: A. Be. B. Ba. C. Ca. D. Mg. Câu 10: Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là (Mg= 24, Ca= 40, Sr= 87, Ba = 137) A. Be và Mg. B. Mg và Ca. C. Sr và Ba. D. Ca và Sr. Câu 11. Khi điện phân muối clorua kim loại nóng chảy, người ta thu được 0,896 lít khí (đktc) ở anot và 3,12 gam kim loại ở catot. Công thức muối clorua đã điện phân là A. NaCl. B. CaCl2. C. KCl. D. MgCl2. Câu 12. Cho 19,2 gam kim loại (M) tan hoàn toàn trong dung dịch HNO3 loãng thì thu được 4,48 lít khí NO (đktc, sản phẩm khử duy nhất). Kim loại (M) là: A. Cu. B. Zn. C. Fe. D. Mg.
DẠNG 4: KIM LOẠI TÁC DỤNG VỚI DUNG DỊCH MUÔI
Câu 1. Hoà tan 58 gam CuSO4. 5H2O vào nước được 500ml dung dịch CuSO4. Cho dần dần mạt sắt vào 50 ml dung dịch trên, khuấy nhẹ cho tới khi dung dịch hết màu xanh thì lượng mạt sắt đã dùng là: A. 0,65g. B. 1,2992g. C. 1,36g. D. 12,99g. Câu 2. Ngâm một đinh sắt sạch trong 200 ml dung dịch CuSO4 sau khi phản ứng kết thúc, lấy đinh sắt ra khỏi dung dịch rửa nhẹ làm khô nhận thấy khối lượng đinh sắt tăng thêm 0,8 gam. Nồng độ mol/lít của dung dịch CuSO4 đã dùng là: A. 0,25M. B. 0,4M. C. 0,3M. D. 0,5M. Câu 3. Ngâm một lá kẽm vào dung dịch có hoà tan 8,32 gam CdSO4. Phản ứng xong lấy lá kẽm ra khỏi dung dịch, rửa nhẹ, làm khô thì thấy khối lượng lá kẽm tăng thêm 2,35% so với khối lượng lá kẽm trước phản ứng. Khối lượng lá kẽm trước phản ứng là: A. 80gam B. 60gam C. 20gam D. 40gam Câu 4. Nhúng một đinh sắt có khối lượng 8 gam vào 500ml dung dịch CuSO4 2M. Sau một thời gian lấy đinh sắt ra cân lại thấy nặng 8,8 gam. Nồng độ mol/l của CuSO4 trong dung dịch sau phản ứng là: A. 0,27M B. 1,36M C. 1,8M D. 2,3M Câu 5: Ngâm lá kẽm trong dung dịch chứa 0,1 mol CuSO4. Phản ứng xong thấy khối lượng lá kẽm: A. tăng 0,1 gam. B. tăng 0,01 gam. C. giảm 0,1 gam. D. không thay đổi. Câu 6: Hoà tan hoàn toàn 28 gam bột Fe vào dung dịch AgNO3 dư thì khối lượng chất rắn thu được là A. 108 gam. B. 162 gam. C. 216 gam. D. 154 gam. Câu 7: Nhúng 1 thanh nhôm nặng 50 gam vào 400ml dung dịch CuSO4 0,5M. Sau một thời gian lấy thanh nhôm ra cân nặng 51,38 gam. Hỏi khối lượng Cu thoát ra là bao nhiêu? A. 0,64gam. B. 1,28gam. C. 1,92gam. D. 2,56gam. Câu 8: Ngâm một lá Fe trong dung dịch CuSO4. Sau một thời gian phản ứng lấy lá Fe ra rửa nhẹ làm khô, đem cân thấy khối lượng tăng thêm 1,6 gam. Khối lượng Cu bám trên lá Fe là bao nhiêu gam? A. 12,8 gam. B. 8,2 gam. C. 6,4 gam. D. 9,6 gam. Câu 9: Ngâm một lá kẽm trong 100 ml dung dịch AgNO3 0,1M. Khi phản ứng kết thúc, khối lượng lá kẽm tăng thêm A. 0,65 gam. B. 1,51 gam. C. 0,755 gam. D. 1,3 gam. DẠNG 5: NHIỆT LUYỆNCâu 1: Cho V lít hỗn hợp khí (ở đktc) gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe3O4 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là A. 0,448. B. 0,112. C. 0,224. D. 0,560. Câu 2: Dẫn từ từ V lít khí CO (ở đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. Giá trị của V là A. 1,120. B. 0,896. C. 0,448. D. 0,224. Câu 3: Cho khí CO khử hoàn toàn đến Fe một hỗn hợp gồm: FeO, Fe2O3, Fe3O4 thấy có 4,48 lít CO2 (đktc) thoát ra. Thể tích CO (đktc) đã tham gia phản ứng là A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít. Câu 4: Thổi một luồng khí CO đi qua ống sứ đựng m gam hỗn hợp Fe3O4 và CuO nung nóng thu được 2,32 gam hỗn hợp rắn. Toàn bộ khí thoát ra cho hấp thụ hết vào bình đựng dung dịch Ca(OH)2 dư thu được 5 gam kết tủa. Giá trị của m là: A. 3,22 gam. B. 3,12 gam. C. 4,0 gam. D. 4,2 gam. Câu 5: Để khử hoàn toàn 30 gam hỗn hợp CuO, FeO, Fe2O3, Fe3O4, MgO cần dùng 5,6 lít khí CO (ở đktc). Khối lượng chất rắn sau phản ứng là A. 28 gam. B. 26 gam. C. 22 gam. D. 24 gam. Câu 6: Khử hoàn toàn 17,6 gam hỗn hợp X gồm Fe, FeO, Fe2O3 cần 2,24 lít CO (ở đktc). Khối lượng sắt thu được là A. 5,6 gam. B. 6,72 gam. C. 16,0 gam. D. 8,0 gam. Câu 7: Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là A. 0,8 gam. B. 8,3 gam. C. 2,0 gam. D. 4,0 gam. Câu 8. Cho dòng khí CO dư đi qua hỗn hợp (X) chứa 31,9 gam gồm Al2O3, ZnO, FeO và CaO thì thu được 28,7 gam hỗn hợp chất rắn (Y). Cho toàn bộ hỗn hợp chất rắn (Y) tác dụng với dung dịch HCl dư thu được V lít H2 (đkc). Giá trị V là A. 5,60 lít. B. 4,48 lít. C. 6,72 lít. D. 2,24 lít. Câu 9. Để khử hoàn toàn 45 gam hỗn hợp gồm CuO, FeO, Fe3O4, Fe và MgO cần dùng vừa đủ 8,4 lít CO ở (đktc). Khối lượng chất rắn thu được sau phản ứng là: A. 39g B. 38g C. 24g D. 42g DẠNG 6: ĐIỆN PHÂN Câu 1. Khi cho dòng điện một chiều I=2A qua dung dịch CuCl2 trong 10 phút. Khối lượng đồng thoát ra ở catod là A. 40 gam. B. 0,4 gam. C. 0,2 gam. D. 4 gam. Câu 2. Điện phân đến hết 0,1 mol Cu(NO3)2 trong dung dịch với điện cực trơ, thì sau điện phân khối lượng dung dịch đã giảm bao nhiêu gam? A. 1,6 gam. B. 6,4 gam. C. 8,0 gam. D. 18,8 gam. Câu 3. Điện phân dùng điện cực trơ dung dịch muối sunfat kim loại hoá trị 2 với cường độ dòng điện 3A. Sau 1930 giây thấy khối lượng catot tăng 1,92 gam. Muối sunfat đã điện phân là A. CuSO4. B. NiSO4. C. MgSO4. D. ZnSO4. Câu 4. Điện phân hoàn toàn 1 lít dung dịch AgNO3 với 2 điên cực trơ thu được một dung dịch có pH= 2. Xem thể tích dung dịch thay đổi không đáng kể thì lượng Ag bám ở catod là: A. 0,54 gam. B. 0,108 gam. C. 1,08 gam. D. 0,216 gam. Câu 5: Điện phân 200 ml dung dịch muối CuSO4 trong thời gian, thấy khối lượng dung dịch giảm 8 gam. Dung dịch sau điện phân cho tác dụng với dd H2S dư thu được 9,6g kết tủa đen. Nồng độ mol của dung dịch CuSO4 ban đầu là A. 1M. B.0,5M. C. 2M. D. 1,125M. Câu 6: Điện phân dung dịch AgNO3 (điện cực trơ) trong thời gian 15 phút, thu được 0,432 gam Ag ở catot. Sau đó để làm kết tủa hết ion Ag+ còn lại trong dung dịch sau điện phân cần dùng 25 ml dung dịch NaCl 0,4M. Cường độ dòng điện và khối lượng AgNO3 ban đầu là (Ag=108) A. 0,429 A và 2,38 gam. B. 0,492 A và 3,28 gam. C. 0,429 A và 3,82 gam. D. 0,249 A và 2,38 gam. Câu 7: Điện phân 200 ml dung dịch AgNO3 0,4M (điện cực trơ) trong thời gian 4 giờ, cường độ dòng điện là 0,402A. Nồng độ mol/l các chất có trong dung dịch sau điện phân là A. AgNO3 0,15M và HNO3 0,3M. B. AgNO3 0,1M và HNO3 0,3M. C. AgNO3 0,1M D. HNO3 0,3M Câu 8: Sau một thời gian điện phân 200 ml dung dịch CuCl2 thu được 1,12 lít khí X (ở đktc). Ngâm đinh sắt vào dung dịch sau điện phân, khi phản ứng xảy ra hoàn toàn thấy khối lượng đinh sắt tăng thêm 1,2 gam. Nồng độ mol của CuCl2 ban đầu là A. 1M. B. 1,5M. C. 1,2M. D. 2M. Câu 9: Điện phân bằng điện cực trơ dung dịch muối sunfat của kim loại hoá trị II với dòng điện có cường độ 6A. Sau 29 phút điện phân thấy khối lượng catot tăng lên 3,45 gam. Kim loại đó là: A. Zn. B. Cu. C. Ni. D. Sn. Câu 10: Điện phân 400 ml dung dịch CuSO4 0,2M với cường độ dòng điện 10A trong 1 thời gian thu được 0,224 lít khí (đkc) ở anot. Biết điện cực đã dùng là điện cực trơ và hiệu suất điện phân là 100%. Khối lượng catot tăng là A. 1,28 gam. B. 0,32 gam. C. 0,64 gam. D. 3,2 gam.
KIM LOẠI KIỀM VÀ HỢP CHẤT
Câu 1: Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IA là A. 3. B. 2. C. 4. D. 1. Câu 2: Công thức chung của oxit kim loại thuộc nhóm IA là A. R2O3. B. RO2. C. R2O. D. RO. Câu 3: Cấu hình electron của nguyên tử Na (Z =11) là A. 1s22s2 2p6 3s2. B. 1s22s2 2p6. C. 1s22s2 2p6 3s1. D. 1s22s2 2p6 3s23p1. Câu 4: Chất phản ứng được với dung dịch NaOH tạo kết tủa là A. KNO3. B. FeCl3. C. BaCl2. D. K2SO4. Câu 5: Dung dịch làm quỳ tím chuyển sang màu xanh là A. NaCl. B. Na2SO4. C. NaOH. D. NaNO3. Câu 6: Sản phẩm tạo thành có chất kết tủa khi dung dịch Na2CO3 tác dụng với dung dịch A. KCl. B. KOH. C. NaNO3. D. CaCl2. Câu 7: Khi nhiệt phân hoàn toàn NaHCO3 thì sản phẩm của phản ứng nhiệt phân là A. NaOH, CO2, H2. B. Na2O, CO2, H2O. C. Na2CO3, CO2, H2O. D. NaOH, CO2, H2O. Câu 8: Để bảo quản natri, người ta phải ngâm natri trong A. nước. B. rượu etylic. C. dầu hỏa. D. phenol lỏng. Câu 9: Một muối khi tan vào nước tạo thành dung dịch có môi trường kiềm, muối đó là A. Na2CO3. B. MgCl2. C. KHSO4. D. NaCl. Câu 10: Có thể dùng NaOH (ở thể rắn) để làm khô các chất khí A. NH3, O2, N2, CH4, H2 B. N2, Cl2, O2, CO2, H2 C. NH3, SO2, CO, Cl2 D. N2, NO2, CO2, CH4, H2 Câu 11: Trong công nghiệp, natri hiđroxit được sản xuất bằng phương pháp A. điện phân dung dịch NaCl, không có màng ngăn điện cực. B. điện phân dung dịch NaCl, có màng ngăn điện cực C. điện phân dung dịch NaNO3 , không có màn ngăn điện cực D. điện phân NaCl nóng chảy Câu 12: Cho dãy các chất: FeCl2, CuSO4, BaCl2, KNO3. Số chất trong dãy phản ứng được với dung dịch NaOH là A. 2. B. 1. C. 3. D. 4. Câu 13: Phản ứng nhiệt phân không đúng là A. 2KNO3  2KNO2 + O2. B. NaHCO3 2KNO2 + O2. B. NaHCO3 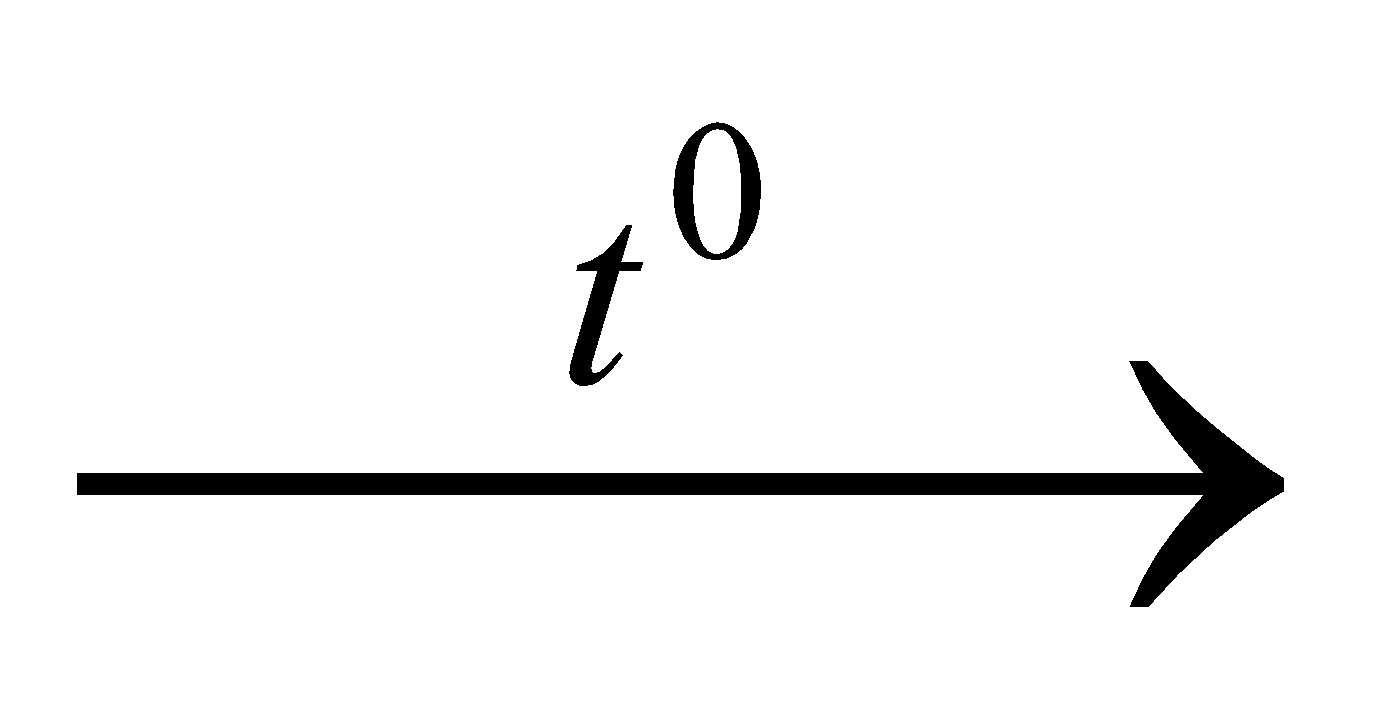 NaOH + CO2. NaOH + CO2. C. NH4Cl 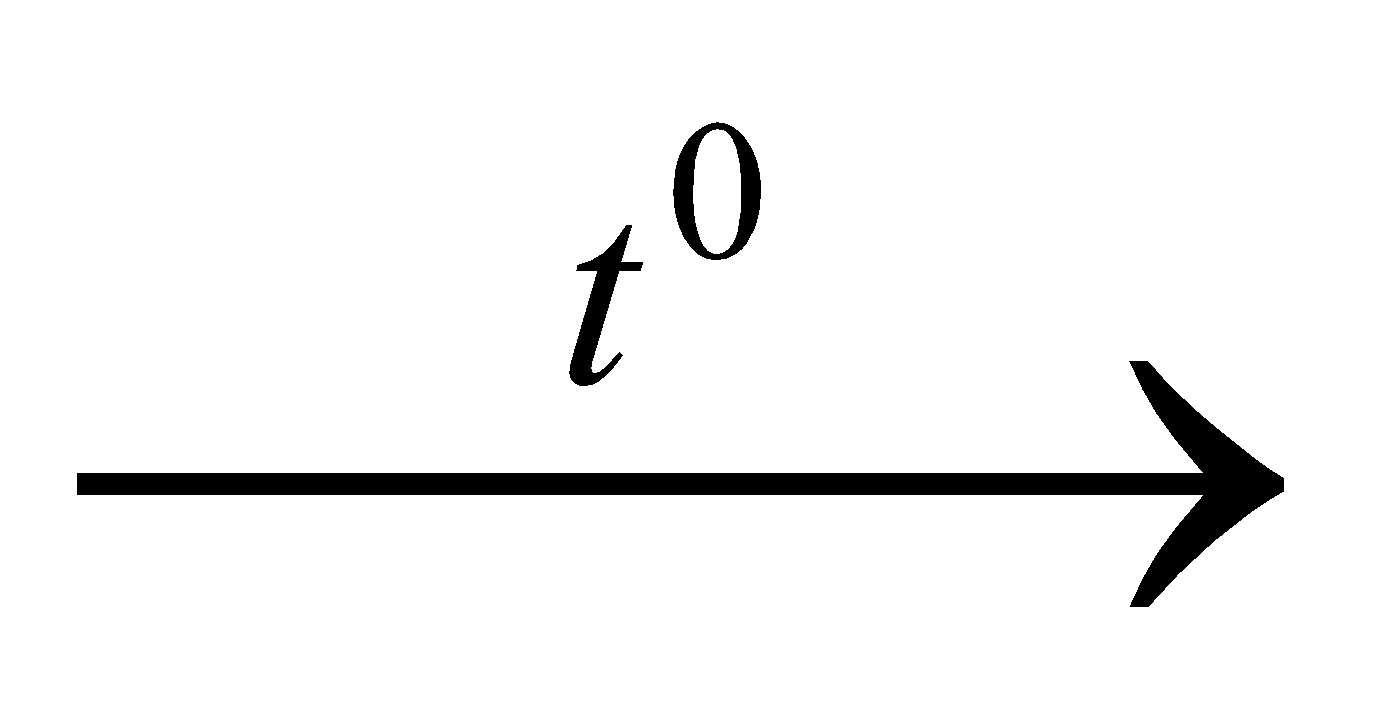 NH3 + HCl. D. NH4NO2 NH3 + HCl. D. NH4NO2  N2 + 2H2O. N2 + 2H2O. Câu 14: Quá trình nào sau đây, ion Na+ không bị khử thành Na? A. Điện phân NaCl nóng chảy. B. Điện phân dung dịch NaCl trong nước C. Điện phân NaOH nóng chảy. D. Điện phân Na2O nóng chảy Câu 15: Quá trình nào sau đây, ion Na+ bị khử thành Na? A. Dung dịch NaOH tác dụng với dung dịch HCl. B. Điện phân NaCl nóng chảy. C. Dung dịch Na2CO3 tác dụng với dung dịch HCl. D. Dung dịch NaCl tác dụng với dung dịch AgNO3. Câu 16: Trong quá trình điện phân dung dịch NaCl, ở cực âm xảy ra: A. sự khử ion Na+. B. Sự oxi hoá ion Na+. C. Sự khử phân tử nước. D. Sự oxi hoá phân tử nước Câu 17: Trong quá trình điện phân dung dịch KBr, phản ứng nào sau đây xảy ra ở cực dương? A. Ion Br− bị oxi hoá. B. ion Br− bị khử. C. Ion K+ bị oxi hoá. D. Ion K+ bị khử. Câu 18: Những đặc điểm nào sau đây không là chung cho các kim loại kiềm? A. số oxihoá của nguyên tố trong hợp chất. B. số lớp electron. C. số electron ngoài cùng của nguyên tử. D. cấu tạo đơn chất kim loại. Câu 19: Điện phân NaCl nóng chảy với điện cực trơ, ở catôt thu được A. Na. B. NaOH. C. Cl2. D. HCl. Câu 20: Trường hợp không xảy ra phản ứng với NaHCO3 khi : A. tác dụng với kiềm. B. tác dụng với CO2. C. đun nóng. D. tác dụng với axit. Câu 21: Cho sơ đồ phản ứng: NaHCO3 + X  Na2CO3 + H2O. X là hợp chất Na2CO3 + H2O. X là hợp chất A. KOH B. NaOH C. K2CO3 D. HCl Câu 22: Cho 0,02 mol Na2CO3 tác dụng với lượng dư dung dịch HCl thì thể tích khí CO2 thoát ra (ở đktc) là A. 0,672 lít. B. 0,224 lít. C. 0,336 lít. D. 0,448 lít. Câu 23: Trung hoà V ml dung dịch NaOH 1M bằng 100 ml dung dịch HCl 1M. Giá trị của V là A. 400. B. 200. C. 100. D. 300. Câu 24: Hấp thụ hoàn toàn 2,24 lít khí CO2 (ở đktc) vào dung dịch chứa 8 gam NaOH, thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là (Cho C = 12, O = 16, Na = 23) A. 10,6 gam. B. 5,3 gam. C. 21,2 gam. D. 15,9 gam. Câu 25: Điện phân muối clorua kim loại kiềm nóng chảy thu được 1,792 lít khí (đktc) ở anot và 6,24 gam kim loại ở catot. Công thức hoá học của muối đem điện phân là A. LiCl. B. NaCl. C. KCl. ,D. RbCl. Câu 26: Cho 0,69 gam một kim loại kiềm tác dụng với nước (dư) thu được 0,336 lít khí hiđro (ở đktc). Kim loại kiềm là (Cho Li = 7, Na = 23, K = 39, Rb = 85) A. Rb. B. Li. C. Na. D. K. Câu 27: Để tác dụng hết với dung dịch chứa 0,01 mol KCl và 0,02 mol NaCl thì thể tích dung dịch AgNO3 1M cần dùng là A. 40 ml. B. 20 ml. C. 10 ml. D. 30 ml. Câu 28: Hấp thụ hoàn toàn 4,48 lít khí SO2 (ở đktc) vào dung dịch chứa 16 gam NaOH thu được dung dịch X. Khối lượng muối tan thu được trong dung dịch X là (Cho H = 1, O = 16, Na = 23, S = 32) A. 20,8 gam. B. 23,0 gam. C. 25,2 gam. D. 18,9 gam. Câu 29: Cho 6,08 gam hỗn hợp NaOH và KOH tác dụng hết với dung dịch HCl tạo ra 8,30 gam hỗn hợp muối clorua. Số gam mỗi hidroxit trong hỗn hợp lần lượt là: A. 2,4 gam và 3,68 gam. B. 1,6 gam và 4,48 gam. C. 3,2 gam và 2,88 gam. D. 0,8 gam và 5,28 gam. Câu 30: Cho 100 gam CaCO3 tác dụng với axit HCl dư. Khí thoát ra hấp thụ bằng 200 gam dung dịch NaOH 30%. Lượng muối Natri trong dung dịch thu được là A. 10,6 gam Na2CO3 B. 53 gam Na2CO3 và 42 gam NaHCO3 C. 16,8 gam NaHCO3 D. 79,5 gam Na2CO3 và 21 gam NaHCO3 Câu 31: Cho 6 lít hỗn hợp CO2 và N2 (đktc) đi qua dung dịch KOH tạo ra 2,07 gam K2CO3 và 6 gam KHCO3. Thành phần % thể tích của CO2 trong hỗn hợp là A. 42%. B. 56%. C. 28%. D. 50%. Câu 32: Thêm từ từ từng giọt dung dịch chứa 0,07 mol HCl vào dung dịch chứa 0,06 mol Na2CO3. Thể tích khí CO2 (đktc) thu được bằng: A. 0,784 lít. B. 0,560 lít. C. 0,224 lít. D. 1,344 lít. Câu 33: Cho hỗn hợp các kim loại kiềm Na, K hòa tan hết vào nước được dung dịch A và 0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần để trung hòa hết một phần ba dung dịch A là A. 100 ml. B. 200 ml. C. 300 ml. D. 600 ml. Câu 34: Thêm từ từ đến hết dung dịch chứa 0,02 mol K2CO3 vào dung dịch chứa 0,03 mol HCl. Lượng khí CO2 thu được (đktc) bằng : A. 0,448 lít B. 0,224 lít. C. 0,336 lít. D. 0,112 lít. Câu 35: Dẫn khí CO2 điều chế được bằng cách cho 10 gam CaCO3 tác dụng với dung dịch HCl dư đi vào dung dịch có chứa 8 gam NaOH. Khối lượng muối Natri điều chế được (cho Ca = 40, C=12, O =16) A. 5,3 gam. B. 9,5 gam. C. 10,6 gam. D. 8,4 gam. Câu 36: Cho 1,15 gam một kim loại kiềm X tan hết vào nước. Để trung hoà dung dịch thu được cần 50 gam dung dịch HCl 3,65%. X là kim loại nào sau đây? A. K. B. Na. C. Cs. D. Li. Câu 37: Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam Kali tác dụng với 108,2 gam H2O là A. 5,00% B. 6,00% C. 4,99%. D. 4,00% Câu 38: Hoà tan m gam Na kim loại vào nước thu được dung dịch X. Trung hoà dung dịch X cần 100ml dung dịch H2SO4 1M. Giá trị m đã dùng là A. 6,9 gam. B. 4,6 gam. C. 9,2 gam. D. 2,3 gam. Câu 39: Cho 5,6 lit CO2 (đktc) hấp thụ hoàn toàn vào 1 lit dung dịch NaOH 0,6M, số mol các chất trong dung dịch sau phản ứng là A. 0,25 mol Na2CO3; 0,1 mol NaHCO3. B. 0,25 mol Na2CO3; 0,1 mol NaOH. C. 0,5 mol Na2CO3; 0,1 mol NaOH. D. 0,5 mol Na2CO3; 0,5 mol NaHCO3. Câu 40: Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị 2, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75 ml dung dịch NaOH 1M, khối lượng muối khan thu được sau phản ứng là A. 5,8 gam. B. 6,5 gam. C. 4,2 gam. D. 6,3 gam.
KIM LOẠI KIỀM THỔ VÀ HỢP CHẤT
Câu 1: Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IIA là A. 3. B. 2. C. 4. D. 1. Câu 2: Trong bảng tuần hoàn, Mg là kim loại thuộc nhóm A. IIA. B. IVA. C. IIIA. D. IA. Câu 3: Khi đun nóng dung dịch canxi hiđrocacbonat thì có kết tủa xuất hiện. Tổng các hệ số tỉ lượng trong phương trình hóa học của phản ứng là A. 4. B. 5. C. 6. D. 7. Câu 4: Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là A. Be, Na, Ca. B. Na, Ba, K. C. Na, Fe, K. D. Na, Cr, K. Câu 5: Để phân biệt hai dung dịch KNO3 và Zn(NO3)2 đựng trong hai lọ riêng biệt, ta có thể dùng dung dịch A. HCl. B. NaOH. C. NaCl. D. MgCl2. Câu 6: Kim loại không phản ứng với nước ở nhiệt độ thường là A. Fe. B. Na. C. Ba. D. K. Câu 7: Hai kim loại đều thuộc nhóm IIA trong bảng tuần hoàn là A. Sr, K. B. Na, Ba. C. Be, Al. D. Ca, Ba. Câu 8: Chất có thể dùng làm mềm nước cứng tạm thời là A. NaCl. B. NaHSO4. C. Ca(OH)2. D. HCl. Câu 9: Kim loại không phản ứng với nước ở nhiệt độ thường là A. Na. B. Ba. C. Be. D. Ca. Câu 10: Phương pháp thích hợp điều chế kim loại Ca từ CaCl2 là A. nhiệt phân CaCl2. B. dùng Na khử Ca2+ trong dung dịch CaCl2. C. điện phân dung dịch CaCl2. D. điện phân CaCl2 nóng chảy. Câu 11: Chất phản ứng được với dung dịch H2SO4 tạo ra kết tủa là A. NaOH. B. Na2CO3. C. BaCl2. D. NaCl. Câu 12: Nước cứng là nước có chứa nhiều các ion A. Cu2+, Fe3+. B. Al3+, Fe3+. C. Na+, K+. D. Ca2+, Mg2+. Câu 13: Hai chất được dùng để làm mềm nước cứng vĩnh cửu là A. Na2CO3 và HCl. B. Na2CO3 và Na3PO4. C. Na2CO3 và Ca(OH)2. D. NaCl và Ca(OH)2. Câu 14: Nước cứng không gây ra tác hại nào dưới đây? A. Gây ngộ độc nước uống. B. Làm mất tính tẩy rửa của xà phòng, làm hư hại quần áo. C. Làm hỏng các dung dịch pha chế. Làm thực phẩm lâu chín và giảm mùi vị thực phẩm. D. Gây hao tốn nhiên liệu và không an toàn cho các nồi hơi, làm tắc các đường ống dẫn nước. Câu 15: Cho các hiđroxit: NaOH, Mg(OH)2, Fe(OH)3, Al(OH)3. Hiđroxit có tính bazơ mạnh nhất là A. NaOH. B. Mg(OH)2. C. Fe(OH)3. D. Al(OH)3. Câu 16: Cặp chất không xảy ra phản ứng là A. Na2O và H2O. B. dung dịch NaNO3 và dung dịch MgCl2. C. dung dịch AgNO3 và dung dịch KCl. D. dung dịch NaOH và Al2O3. Câu 17: Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có A. bọt khí và kết tủa trắng. B. bọt khí bay ra. C. kết tủa trắng xuất hiện. D. kết tủa trắng sau đó kết tủa tan dần. Câu 18: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có A. bọt khí và kết tủa trắng. B. bọt khí bay ra. C. kết tủa trắng xuất hiện. D. kết tủa trắng, sau đó kết tủa tan dần. Câu 19: Cho dãy các kim loại: Fe, Na, K, Ca. Số kim loại trong dãy tác dụng được với nước ở nhiệt độ thường là A. 4. B. 1. C. 2. D. 3. Câu 20: Sản phẩm tạo thành có chất kết tủa khi dung dịch Ba(HCO3)2 tác dụng với dung dịch A. HNO3. B. HCl. C. Na2CO3. D. KNO3. Câu 21: Cho 10 gam một kim loại kiềm thổ tác dụng hết với nước thoát ra 5,6 lít khí (đktc). Tên của kim loại kiềm thổ đó là A. Ba. B. Mg. C. Ca. D. Sr. Câu 22: Cho 10 lít hỗn hợp khí (đktc) gồm CO2 và 68,64% CO về thể tích đi qua 100 gam dung dịch Ca(OH)2 7,4% thấy tách ra m gam kết tủa. Trị số của m bằng A. 10 gam. B. 8 gam. C. 6 gam. D. 12 gam. Câu 23: Cho 10 ml dung dịch muối Canxi tác dụng với dung dịch Na2CO3 dư tách ra một kết tủa, lọc và đem nung kết tuả đến lượng không đổi còn lại 0,28 gam chất rắn. Khối lượng ion Ca2+ trong 1 lít dung dịch đầu là A. 10 gam B. 20 gam. C. 30 gam. D. 40 gam. Câu 24: Hoà tan 8,2 gam hỗn hợp bột CaCO3 và MgCO3 trong nước cần 2,016 lít khí CO2 (đktc). Số gam mỗi muối ban đầu là A. 2,0 gam và 6,2 gam B. 6,1 gam và 2,1 gam C. 4,0 gam và 4,2 gam D. 1,48 gam và 6,72 gam Câu 29: Thổi V lít (đktc) khí CO2 vào 300 ml dung dịch Ca(OH)2 0,02M thì thu được 0,2 gam kết tủa. Giá trị của V là: A. 44,8 ml hoặc 89,6 ml B. 224 ml C. 44,8 ml hoặc 224 ml D. 44,8 ml Câu 25: Dẫn 17,6 gam CO2 vào 500 ml dung dịch Ca(OH)2 0,6M. Phản ứng kết thúc thu được bao nhiêu gam kết tủa? A. 20 gam. B. 30 gam. C. 40 gam. D. 25 gam. Câu 26: Dẫn V lit CO2 (đktc) vào dung dịch Ca(OH)2 thu được 25 gam kết tủa và dung dịch X, đun nóng dung dịch lại thu thêm được 5 gam kết tủa nữa. Giá trị của V là A. 7,84 lit B. 11,2 lit C. 6,72 lit D. 5,6 lit Câu 27: Khi trộn lẫn dung dịch chứa 0,15 mol NaHCO3 với dung dịch chứa 0,10 mol Ba(OH)2, sau phản ứng thu được m gam kết tủa trắng. Giá trị m là (Cho C = 12, O = 16, Na = , Ba = 137) A. 39,40 gam. B. 19,70 gam. C. 39,40 gam. D. 29,55 gam. Câu 28: Hoà tan hoàn toàn 8,4 gam muối cacbonat của kim loại M (MCO3) bằng dung dịch H2SO4 loãng vừa đủ, thu được một chất khí và dung dịch G1. Cô cạn G1, được 12,0 gam muối sunfat trung hoà, khan. Công thức hoá học của muối cacbonat là (Cho C = 12, O = 16, Mg = 24, Ca = 40, Fe = 56, Ba = 137) A. CaCO3. B. MgCO3. C. BaCO3. D. FeCO3. Câu 29: Hoà tan hết 5,00 gam hỗn hợp gồm một muối cacbonat của kim loại kiềm và một muối cacbonat của kim loại kiềm thổ bằng dung dịch HCl thu được 1,68 lít CO2(đkc). Cô cạn dung dịch sau phản ứng sẽ thu được một hỗn hợp muối khan nặng A. 7,800 gam. B. 5,825 gam. C. 11,100 gam. D. 8,900 gam. Câu 30: Cho một mẫu hợp kim Na-Ba tác dụng với nước (dư) thu được dung dịch X và 3,36 lít H2 (ở đktc). Thể tích dung dịch axit H2SO4 2M cần dùng để trung hòa dung dịch X là A. 150 ml B. 60 ml C. 75 ml D. 30 ml Câu 31: Hấp thụ hoàn toàn 2,688 lít khí CO2 (ở đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mol/l, thu được 15,76 gam kết tủa. Giá trị của a là (cho C = 12, O = 16, Ba = 137) A. 0,032. B. 0,04. C. 0,048. D. 0,06.
NHÔM VÀ HỢP CHẤT CỦA NHÔM
Câu 1: Số electron lớp ngoài cùng của nguyên tử Al là A. 4. B. 3. C. 1. D. 2. Câu 2: Al2O3 phản ứng được với cả hai dung dịch: A. Na2SO4, KOH. B. NaOH, HCl. C. KCl, NaNO3. D. NaCl, H2SO4. Câu 3: Mô tả nào dưới đây không phù hợp với nhôm? A. Ở ô thứ 13, chu kì 2, nhóm IIIA. B. Cấu hình electron [Ne] 3s2 3p1. C. Tinh thể cấu tạo lập phương tâm diện. D. Mức oxi hóa đặc trưng +3. Câu 4: Kim loại Al không phản ứng với dung dịch A. NaOH loãng. B. H2SO4 đặc, nguội. C. H2SO4 đặc, nóng. D. H2SO4 loãng. Câu 5: Ở nhiệt độ thường, kim loại Al tác dụng được với dung dịch A. Mg(NO3)2. B. Ca(NO3)2. C. KNO3. D. Cu(NO3)2. Câu 6: Chất phản ứng được với dung dịch NaOH là A. Mg(OH)2. B. Ca(OH)2. C. KOH. D. Al(OH)3. Câu 7: Để phân biệt dung dịch AlCl3 và dung dịch KCl ta dùng dung dịch A. NaOH. B. HCl. C. NaNO3. D. H2SO4. Câu 8: Nguyên liệu chính dùng để sản xuất nhôm là A. quặng pirit. B. quặng boxit. C. quặng manhetit. D. quặng đôlômit. Câu 9: Chỉ dùng dung dịch KOH để phân biệt được các chất riêng biệt trong nhóm nào sau đây? A. Zn, Al2O3, Al. B. Mg, K, Na. C. Mg, Al2O3, Al. D. Fe, Al2O3, Mg. Câu 10: Kim loại phản ứng được với dung dịch NaOH là A. Ag. B. Cu. C. Fe. D. Al. Câu 11: Chất có tính chất lưỡng tính là A. NaCl. B. Al(OH)3. C. AlCl3. D. NaOH. Câu 12: Cho phản ứng: aAl + bHNO3  cAl(NO3)3 + dNO + eH2O. cAl(NO3)3 + dNO + eH2O. Hệ số a, b, c, d, e là các số nguyên, tối giản. Tổng (a + b) bằng A. 5. B. 4. C. 7. D. 6. Câu 13: Kim loại Al không phản ứng với dung dịch A. H2SO4 đặc, nguội. B. Cu(NO3)2. C. HCl. D. NaOH. Câu 14: Chất phản ứng được với dung dịch NaOH là A. Al2O3. B. MgO. C. KOH. D. CuO. Câu 15: Chất không có tính chất lưỡng tính là A. NaHCO3. B. AlCl3. C. Al(OH)3. D. Al2O3. Câu 16: Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm? A. Al tác dụng với Fe2O3 nung nóng B. Al tác dụng với CuO nung nóng. C. Al tác dụng với Fe3O4 nung nóng D. Al tác dụng với axit H2SO4 đặc nóng Câu 17: Al2O3 phản ứng được với cả hai dung dịch: A. KCl, NaNO3. B. Na2SO4, KOH. C. NaCl, H2SO4. D. NaOH, HCl. Câu 18: Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là A. có kết tủa keo trắng và có khí bay lên. B. có kết tủa keo trắng, sau đó kết tủa tan. C. chỉ có kết tủa keo trắng. D. không có kết tủa, có khí bay lên. Câu 19: Sục khí CO2 đến dư vào dung dịch NaAlO2. Hiện tượng xảy ra là A. có kết tủa nâu đỏ. B. có kết tủa keo trắng, sau đó kết tủa lại tan. C. có kết tủa keo trắng. D. dung dịch vẫn trong suốt. Câu 20: Nhôm hidroxit thu được từ cách nào sau đây? A. Cho dư dung dịch HCl vào dung dịch natri aluminat. B. Thổi khí CO2 vào dung dịch natri aluminat. C. Cho dư dung dịch NaOH vào dung dịch AlCl3. D. Cho Al2O3 tác dụng với nước Câu 21: Các dung dịch MgCl2 và AlCl3 đều không màu. Để phân biệt 2 dung dịch này có thể dùng dung dịch của chất nào sau đây? A. NaOH. B. HNO3. C. HCl. D. NaCl. Câu 22: Cho 2,7 gam Al tác dụng hoàn toàn với dung dịch NaOH dư. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là (Cho Al = 27) A. 3,36 lít. B. 2,24 lít. C. 4,48 lít. D. 6,72 lít. Câu 23: Cho bột nhôm tác dụng với dung dịch NaOH (dư) thu được 6,72 lít khí H2 (ở đktc). Khối lượng bột nhôm đã phản ứng là (Cho Al = 27) A. 2,7 gam. B. 10,4 gam. C. 5,4 gam. D. 16,2 gam. Câu 24: Cho 5,4 gam bột nhôm tác dụng với 100 ml dung dịch NaOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn thu được V lít khí hiđro (ở đktc). Giá trị của V là (Cho H = 1, Al = 27) A. 0,336 lít. B. 0,672 lít. C. 0,448 lít. D. 0,224 lít. Câu 25: Hoà tan m gam Al vào dung dịch HNO3 rất loãng chỉ thu được hỗn hợp khí gồm 0,015 mol N2O và 0,01 mol NO. Giá trị của m là A. 8,1 gam. B. 1,53 gam. C. 1,35 gam. D. 13,5 gam. Câu 26: Để khử hoàn toàn m gam hỗn hợp CuO và PbO cần 8,1 gam kim loại nhôm, sau phản ứng thu được 50,2 gam hỗn hợp 2 kim loại. Giá trị của m là A. 54,4 gam. B. 53,4 gam. C. 56,4 gam. D. 57,4 gam. Câu 27: Hòa tan hết m gam hỗn hợp Al và Fe trong lượng dư dung dịch H2SO4 loãng thoát ra 0,4 mol khí, còn trong lượng dư dung dịch NaOH thì thu được 0,3 mol khí. Giá trị m đã dùng là A. 11,00 gam. B. 12,28 gam. C. 13,70 gam. D. 19,50 gam. Câu 28: Cho m gam hỗn hợp bột Al và Fe tác dụng với dung dịch NaOH dư thoát ra 6,72 lít khí (đktc). Nếu cho m gam hỗn hợp trên tác dụng với dung dịch HCl dư thì thoát ra 8,96 lít khí (đktc). Khối lượng của Al và Fe trong hỗn hợp đầu là A. 10,8 gam Al và 5,6 gam Fe. B. 5,4 gam Al và 5,6 gam Fe. C. 5,4 gam Al và 8,4 gam Fe. D. 5,4 gam Al và 2,8 gam Fe. Câu 29: 31,2 gam hỗn hợp bột Al và Al2O3 tác dụng với dung dịch NaOH dư thoát ra 13,44 lít khí (đktc). Khối lượng mỗi chất trong hỗn hợp đầu là A. 21,6 gam Al và 9,6 gam Al2O3 B. 5,4 gam Al và 25,8 gam Al2O3 C. 16,2 gam Al và 15,0 gam Al2O3 D. 10,8 gam Al và 20,4 gam Al2O3 Câu 30: Xử lý 9 gam hợp kim nhôm bằng dung dịch NaOH đặc, nóng (dư) thoát ra 10,08 lít khí (đktc), còn các thành phần khác của hợp kim không phản ứng. Thành phần % của Al trong hợp kim là A. 75%. B. 80%. C. 90%. D. 60%. Câu 31: Hòa tan hoàn toàn hợp kim Al - Mg trong dung dịch HCl, thu được 8,96 lít khí H2 (đktc). Nếu cũng cho một lượng hợp kim như trên tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Thành phần phần trăm theo khối lượng của Al trong hợp kim là A. 69,2%. B. 65,4%. C. 80,2%. D. 75,4%. Câu 32. Cho dung dịch chứa 2,8 gam NaOH tác dụng với dung dịch chứa 3,42 gam Al2(SO4)3. Sau phản ứng khối lượng kết tủa thu được là A. 3,12 gam. B. 2,34 gam. C. 1,56 gam. D. 0,78 gam. Câu 33: Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là (cho H = 1, O = 16, Al = 27) A. 1,2. B. 1,8. C. 2,4. D. 2.
SẮT và HỢP CHẤT
Câu 1: Cấu hình electron nào sau đây là của ion Fe?
A. [Ar] 4s23d6. B. [Ar]3d64s2. C. [Ar]3d8. D. [Ar]3d74s1. Câu 2: Cấu hình electron nào sau đây là của ion Fe2+?
A. [Ar]3d6. B. [Ar]3d5. C. [Ar]3d4. D. [Ar]3d3. Câu 3: Cấu hình electron nào sau đây là của ion Fe3+?
A. [Ar]3d6. B. [Ar]3d5. C. [Ar]3d4. D. [Ar]3d3. Câu 4: Cho phương trình hoá học: aAl + bFe3O4 → cFe + dAl2O3 (a, b, c, d là các số nguyên, tối giản). Tổng các hệ số a, b, c, d là A. 25. B. 24. C. 27. D. 26. Câu 5: Trong các loại quặng sắt, quặng có hàm lượng sắt cao nhất là A. hematit nâu. B. manhetit. C. xiđerit. D. hematit đỏ. Câu 6: Hai dung dịch đều phản ứng được với kim loại Fe là A. CuSO4 và ZnCl2. B. CuSO4 và HCl. C. ZnCl2 và FeCl3. D. HCl và AlCl3. Câu 7: Cho sắt phản ứng với dung dịch HNO3 đặc, nóng thu được một chất khí màu nâu đỏ. Chất khí đó là A. NO2. B. N2O. C. NH3. D. N2. Câu 8: Hoà tan m gam Fe trong dung dịch HCl dư, sau khi phản ứng kết thúc thu được 4,48 lít khí H2 (ở đktc). Giá trị của m là (Cho Fe = 56, H = 1, Cl = 35,5) A. 2,8. B. 1,4. C. 5,6. D. 11,2. Câu 9: Hoà tan hoàn toàn m gam Fe trong dung dịch HNO3 loãng dư, sau khi phản ứng kết thúc thu được 0,448 lít khí NO duy nhất (ở đktc). Giá trị của m là (Cho Fe = 56, H = 1, Cl = 35,5) A. 11,2. B. 0,56. C. 5,60. D. 1,12. Câu 10. Bao nhiêu gam clo tác dụng vừa đủ kim loại sắt tạo ra 32,5 gam FeCl3? A. 21,3 gam B. 14,2 gam. C. 13,2 gam. D. 23,1 gam. Câu 11: Cho 2,52 gam một kim loại tác dụng hết với dung dịch H2SO4 loãng, thu được 6,84 gam muối sunfat. Kim loại đó là:
A. Mg. B. Zn. C. Fe. D. Al. Câu 12: Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thu được 336 ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Kim loại đó là
A. Zn. B. Fe. C. Al. D. Ni. Câu 13: Cho một ít bột sắt nguyên chất tác dụng hết với dung dịch H2SO4 loãng thu được 560 ml một chất khí (ở đktc). Nếu cho một lượng gấp đôi bột sắt nói trên tác dụng hết với dung dịch CuSO4 thì thu được m gam một chất rắn. Giá trị m là A. 1,4 gam. B. 4,2 gam. C. 2,3 gam. D. 3,2 gam. Câu 14: Hỗn hợp X gồm Cu và Fe, trong đó Cu chiếm 43,24% khối lượng. Cho 14,8 gam X tác dụng hết với dung dịch HCl thấy có V lít khí (đktc). Giá trị của V là:
A. 1,12 lít. B. 2,24 lít. C. 4,48 lít. D. 3,36 lít. Câu 15: Nhúng thanh sắt vào dung dịch CuSO4, sau một thời gian lấy thanh sắt ra rửa sạch, sấy khô thấy khối lượng tăng 1,2 gam. Khối lượng Cu đã bám vào thanh sắt là
A. 9,3 gam. B. 9,4 gam. C. 9,5 gam. D. 9,6 gam. Câu 16: Cho sắt tác dụng với dung dịch H2SO4 loãng thu được V lít H2 (đktc), dung dịch thu được cho bay hơi được tinh thể FeSO4.7H2O có khối lượng là 55,6 gam. Thể tích khí H2 (đktc) được giải phóng là
A. 8,19 lít. B. 7,33 lít. C. 4,48 lít. D. 6,23 lít. Câu 17: Ngâm một đinh sắt nặng 4 gam trong dung dịch CuSO4, sau một thời gian lấy đinh sắt ra, sấy khô, cân nặng 4,2857 gam. Khối lượng sắt tham gia phản ứng là
A. 1,9990 gam. B. 1,9999 gam. C. 0,3999 gam. D. 2,1000 gam Câu 18: Hoà tan 58 gam muối CuSO4.5H2O vào nước được 500 ml dung dịch A. Cho dần dần bột sắt vào 50 ml dung dịch A, khuấy nhẹ cho tới khi dung dịch hết màu xanh. Khối lượng sắt đã tham gian phản ứng là A. 1,9922 gam. B. 1,2992 gam. C. 1,2299 gam. D. 2,1992 gam. Câu 19. Một hỗn hợp gồm 13 gam kẽm và 5,6 gam sắt tác dụng với dung dịch axit sunfuric loãng dư. Thể tích khí hidro (đktc) được giải phóng sau phản ứng là. A. 2,24 lit. B. 4,48 lit. C. 6,72 lit. D. 67,2 lit. Câu 20: Hoà tan 5,6 gam Fe bằng dung dịch HNO3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là A. 6,72. B. 4,48. C. 2,24. D. 3,36. Câu 21: Cho 10 gam hỗn hợp gồm Fe và Cu tác dụng với dung dịch H2SO4 loãng (dư). Sau phản ứng thu được 2,24 lít khí hiđro (ở đktc), dung dịch X và m gam chất rắn không tan. Giá trị của m là (Cho H = 1, Fe = 56, Cu = 64) A. 6,4 gam. B. 3,4 gam. C. 5,6 gam. D. 4,4 gam. Câu 22: Cho 20 gam hỗn hợp bột Mg và Fe tác dụng hết với dung dịch HCl thấy có 1 gam khí H2 bay ra. Lượng muối clorua tạo ra trong dung dịch là bao nhiêu gam ? A. 40,5 gam. B. 45,5 gam. C. 55,5 gam. D. 60,5 gam. Câu 23. Cho m gam Fe vào dung dịch HNO3 lấy dư ta thu được 8,96 lit(đkc) hỗn hợp khí X gồm 2 khí NO và NO2 có tỉ khối hơi hỗn hợp X so với oxi bằng 1,3125. Giá trị của m là A. 0,56 gam. B. 1,12 gam. C. 11,2 gam. D. 5,6 gam. Câu 24: Phân hủy Fe(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được chất rắn là A. FeO. B. Fe2O3. C. Fe3O4. D. Fe(OH)2. Câu 25: Sản phẩm tạo thành có chất kết tủa khi dung dịch Fe2(SO4)3 tác dụng với dung dịch A. NaOH. B. Na2SO4. C. NaCl. D. CuSO4. Câu 26: Dãy gồm hai chất chỉ có tính oxi hoá là A. Fe(NO3)2, FeCl3. B. Fe(OH)2, FeO. C. Fe2O3, Fe2(SO4)3. D. FeO, Fe2O3. Câu 27: Cho sơ đồ chuyển hoá: Fe FeCl3 FeCl3 Fe(OH)3 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là Fe(OH)3 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là A. HCl, NaOH. B. HCl, Al(OH)3. C. NaCl, Cu(OH)2. D. Cl2, NaOH. Câu 28: Hợp chất sắt (II) sunfat có công thức là A. FeSO4. B. Fe(OH)3. C. Fe2O3. D. Fe2(SO4)3. Câu 29: Sắt có thể tan trong dung dịch nào sau đây? A. FeCl2 . B. FeCl3. C. MgCl2. D. AlCl3. Câu 30: Hợp chất nào sau đây của sắt vừa có tính oxi hóa, vừa có tính khử? A. FeO. B. Fe2O3. C. Fe(OH)3. D. Fe(NO3)3. Câu 31: Nhận định nào sau đây sai? A. Sắt tan được trong dung dịch CuSO4. B. Sắt tan được trong dung dịch FeCl3. C. Sắt tan được trong dung dịch FeCl2. D. Đồng tan được trong dung dịch FeCl3. Câu 32: Chất có tính oxi hoá nhưng không có tính khử là A. Fe. B. Fe2O3. C. FeCl2. D. FeO. Câu 33: Chất phản ứng với dung dịch FeCl3 cho kết tủa là A. CH3COOCH3. B. CH3OH. C. CH3NH2. D. CH3COOH. Câu 34: Cho phản ứng: a Fe + b HNO3  c Fe(NO3)3 + d NO + e H2O c Fe(NO3)3 + d NO + e H2O Các hệ số a, b, c, d, e là những số nguyên, đơn giản nhất. Thì tổng (a+b) bằng A. 3. B. 6. C. 4. D. 5. Câu 35: Cho dãy các chất: FeCl2, CuSO4, BaCl2, KNO3. Số chất trong dãy phản ứng được với dung dịch NaOH là A. 2. B. 1. C. 3. D. 4. Câu 36: Cho dãy các kim loại: Na, Cu, Fe, Ag, Zn. Số kim loại trong dãy phản ứng được với dung dịch HCl là A. 5. B. 2. C. 3. D. 4. Câu 37: Cho các hợp kim sau: Cu-Fe (I); Zn –Fe (II); Fe-C (III); Sn-Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là: A. I, II và III. B. I, II và IV. C. I, III và IV. D. II, III và IV. Câu 38: Nung 21,4 gam Fe(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được m gam một oxit. Giá trị của m là (Cho H = 1, O = 16, Fe = 56) A. 16. B. 14. C. 8. D. 12. Câu 39: Cho khí CO khử hoàn toàn đến Fe một hỗn hợp gồm: FeO, Fe2O3, Fe3O4 thấy có 4,48 lít CO2 (đktc) thoát ra. Thể tích CO (đktc) đã tham gia phản ứng là A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít. Câu 40: Để khử hoàn toàn 30 gam hỗn hợp CuO, FeO, Fe2O3, Fe3O4, MgO cần dùng 5,6 lít khí CO (ở đktc). Khối lượng chất rắn sau phản ứng là A. 28 gam. B. 26 gam. C. 22 gam. D. 24 gam. Câu 41: Khử hoàn toàn 17,6 gam hỗn hợp X gồm Fe, FeO, Fe2O3 cần 2,24 lít CO (ở đktc). Khối lượng sắt thu được là A. 5,6 gam. B. 6,72 gam. C. 16,0 gam. D. 8,0 gam. Câu 42: Hỗn hợp A gồm FeO, Fe3O4, Fe2O3. Trong hỗn hợp A, mỗi oxit đều có 0,5 mol. Khối lượng của hỗn hợp A là A. 231 gam. B. 232 gam. C. 233 gam. D. 234 gam. Câu 43: Khử hoàn toàn 16 gam Fe2O3 bằng khí CO ở nhiệt độ cao. Khí đi ra sau phản ứng được dẫn vào dung dịch Ca(OH)2 dư. Khối lượng kết tủa thu được là
A. 15 gam B. 20 gam. C. 25 gam. D. 30 gam. Câu 44: Khử hoàn toàn m gam hỗn hợp X gồm FeO và Fe2O3 bằng H2 (to), kết thúc thí nghiệm thu được 9 gam H2O và 22,4 gam chất rắn. % số mol của FeO có trong hỗn hợp X là: A. 66,67%. B. 20%. C. 67,67%. D. 40%. Câu 45: Nung một mẫu thép thường có khối lượng 10 gam trong O2 dư thu được 0,1568 lít khí CO2 (đktc). Thành phần phần trăm theo khối lượng của cacbon trong mẫu thép đó là
A. 0,82%. B. 0,84%. C. 0,85%. D. 0,86%. Câu 46: Hoà tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml axit H2SO4 0,1M (vừa đủ). Sau phản ứng, hỗn hợp muối sunfat khan thu được khi cô cạn dung dịch có khối lượng là A. 3,81 gam. B. 4,81 gam. C. 5,81 gam. D. 6,81 gam. Câu 47: Cho 32 gam hỗn hợp gồm MgO, Fe2O3, CuO tác dụng vừa đủ với 300ml dung dịch H2SO4 2M. Khối lượng muối thu được là
A. 60 gam. B. 80 gam. C. 85 gam. D. 90 gam. Câu 48: Hòa tàn 10 gam hỗn hợp bột Fe và Fe2O3 bằng dd HCl thu được 1,12 lít khí (đktc) và dung dịch A. Cho dung dịch A tác dụng với NaOH dư, thu được kết tủa. Nung kết tủa trong không khí đến khối lượng không đổi được chất rắn có khối lượng là: A. 11,2 gam. B. 12,4 gam. C. 15,2 gam. D. 10,9 gam. Câu 49: Hoà tan 5,6 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là (cho Fe = 56) A. 40. B. 80. C. 60. D. 20.
CRÔM và HỢP CHẤT
Câu 1: Cấu hình electron của ion Cr3+ là:
A. [Ar]3d5. B. [Ar]3d4. C. [Ar]3d3. D. [Ar]3d2. Câu 2: Các số oxi hoá đặc trưng của crom là:
A. +2; +4, +6. B. +2, +3, +6. C. +1, +2, +4, +6. D. +3, +4, +6. Câu 3: Nhỏ từ từ dung dịch H2SO4 loãng vào dung dịch K2CrO4 thì màu của dung dịch chuyển từ A. không màu sang màu vàng. B. màu da cam sang màu vàng. C. không màu sang màu da cam. D. màu vàng sang màu da cam. Câu 4: Oxit lưỡng tính là A. Cr2O3. B. MgO. C. CrO. D. CaO. Câu 5: Cho phản ứng : NaCrO2 + Br2 + NaOH Na2CrO4 + NaBr + H2O Na2CrO4 + NaBr + H2O Khi cân bằng phản ứng trên, hệ số của NaCrO2 là A. 1. B. 2. C. 3. D. 4. Câu 6: Cặp kim loại nào sau đây bền trong không khí và nước do có màng oxit bảo vệ? A. Fe và Al. B. Fe và Cr. C. Mn và Cr. D. Al và Cr. Câu 7: Sục khí Cl2 vào dung dịch CrCl3 trong môi trường NaOH. Sản phẩm thu được là A. Na2Cr2O7, NaCl, H2O. B. Na2CrO4, NaClO3, H2O. C. Na[Cr(OH)4], NaCl, NaClO, H2O. D. Na2CrO4, NaCl, H2O. Câu 8: Khi so sánh trong cùng một điều kiện thì Cr là kim loại có tính khử mạnh hơn A. Fe. B. K. C. Na. D. Ca. Câu 9: Khối luợng K2Cr2O7 cần dùng để oxi hoá hết 0,6 mol FeSO4 trong dung dịch có H2SO4 loãng làm môi trường là (Cho O = 16, K = 39, Cr = 52) A. 29,4 gam B. 59,2 gam. C. 24,9 gam. D. 29,6 gam Câu 10: Muốn điều chế 6,72 lít khí clo (đkc) thì khối luợng K2Cr2O7 tối thiểu cần dùng để tác dụng với dung dịch HCl đặc, dư là (Cho O = 16, K = 39, Cr = 52) A. 29,4 gam B. 27,4 gam. C. 24,9 gam. D. 26,4 gam Câu 11: Để oxi hóa hoàn toàn 0,01 mol CrCl3 thành K2CrO4 bằng Cl2 khi có mặt KOH, lượng tối thiểu Cl2 và KOH tương ứng là A. 0,015 mol và 0,04 mol. B. 0,015 mol và 0,08 mol. C. 0,03 mol và 0,08 mol. D. 0,03 mol và 0,04 mol. Câu 12: Khối lượng bột nhôm cần dùng để thu được 78 gam crom từ Cr2O3 bằng phản ứng nhiệt nhôm (giả sử hiệu suất phản ứng là 100%) là A. 13,5 gam B. 27,0 gam. C. 54,0 gam. D. 40,5 gam Câu 13: Nung hỗn hợp bột gồm 15,2 gam Cr2O3 và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn, thu được 23,3 gam hỗn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với axit HCl (dư) thoát ra V lít khí H2 (ở đktc). Giá trị của V là (cho O = 16, Al = 27, Cr = 52) A. 7,84. B. 4,48. C. 3,36. D. 10,08. Câu 14: Cho 13,5 gam hỗn hợp các kim loại Al, Cr, Fe tác dụng với lượng dư dung dịch H2SO4 loãng nóng (trong điều kiện không có không khí), thu được dung dịch X và 7,84 lít khí H2 (ở đktc). Cô cạn dung dịch X (trong điều kiện không có không khí) được m gam muối khan. Giá trị của m là A. 42,6. B. 45,5. C. 48,8. D. 47,1.
ĐỒNG, KẼM và HỢP CHẤT
Câu 1: Cấu hình electron của ion Cu là
A. [Ar]4s13d10. B. [Ar]4s23d9. C. [Ar]3d104s1. D. [Ar]3d94s2. Câu 2: Cấu hình electron của ion Cu2+ là
A. [Ar]3d7. B. [Ar]3d8. C. [Ar]3d9. D. [Ar]3d10. Câu 3: Cho Cu tác dụng với dung dịch hỗn hợp gồm NaNO3 và H2SO4 loãng sẽ giải phóng khí nào sau đây?
A. NO2. B. NO. C. N2O. D. NH3. Câu 4: Tổng hệ số (các số nguyên, tối giản) của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là A. 10. B. 8. C. 9. D. 11. Câu 5: Có 4 dung dịch muối riêng biệt: CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm dung dịch KOH (dư) vào 4 dung dịch trên thì số chất kết tủa thu được là A. 1. B. 2. C. 3. D. 4. Câu 6: Hai kim loại đều phản ứng với dung dịch Cu(NO3)2 giải phóng kim loại Cu là A. Al và Fe. B. Fe và Au. C. Al và Ag. D. Fe và Ag. Câu 7: Cặp chất không xảy ra phản ứng là A. Fe + Cu(NO3)2. B. Cu + AgNO3. C. Zn + Fe(NO3)2. D. Ag + Cu(NO3)2. Câu 8: Dung dịch FeSO4 và dung dịch CuSO4 đều tác dụng được với A. Ag. B. Fe. C. Cu. D. Zn. Câu 9: Kim loại Cu phản ứng được với dung dịch A. FeSO4. B. AgNO3. C. KNO3. D. HCl. Câu 10: Hai kim loại có thể điều chế bằng phương pháp nhiệt luyện là A. Ca và Fe. B. Mg và Zn. C. Na và Cu. D. Fe và Cu. Câu 11: Chất không khử được sắt oxit (ở nhiệt độ cao) là A. Cu. B. Al. C. CO. D. H2. Câu 12: Dung dịch muối nào sau đây tác dụng được với cả Ni và Pb? A. Pb(NO3)2. B. Cu(NO3)2. C. Fe(NO3)2. D. Ni(NO3)2. Câu 13: Để loại bỏ kim loại Cu ra khỏi hỗn hợp bột gồm Ag và Cu, người ta ngâm hỗn hợp kim loại trên vào lượng dư dung dịch A. AgNO3. B. HNO3. C. Cu(NO3)2. D. Fe(NO3)2. Câu 14: Tất cả các kim loại Fe, Zn, Cu, Ag đều tác dụng được với dung dịch A. HCl. B. H2SO4 loãng. C. HNO3 loãng. D. KOH. Câu 15: Một kim loại phản ứng với dung dịch CuSO4 tạo ra Cu. Kim loại đó là A. Fe. B. Ag. C. Cu. D. Na. Câu 16: Đồng (Cu) tác dụng được với dung dịch A. H2SO4 đặc, nóng. B. H2SO4 loãng. C. FeSO4. D. HCl. Câu 17: Kim loại M phản ứng được với: dung dịch HCl, dung dịch Cu(NO3)2, dung dịch HNO3 (đặc, nguội). Kim loại M là A. Al. B. Zn. C. Fe. D. Ag. Câu 18: Khi cho Cu tác dụng với dung dịch chứa H2SO4 loãng và NaNO3, vai trò của NaNO3 trong phản ứng là A. chất xúc tác. B. chất oxi hoá. C. môi trường. D. chất khử. Câu 19: Trường hợp xảy ra phản ứng là A. Cu + Pb(NO3)2 (loãng) → B. Cu + HCl (loãng) → C. Cu + HCl (loãng) + O2 → D. Cu + H2SO4 (loãng) → Câu 20: Hợp chất nào sau đây không có tính lưỡng tính?
A. ZnO. B. Zn(OH)2. C. ZnSO4. D. Zn(HCO3)2. Câu 21: Cho dung dịch NaOH vào dung dịch muối sunfat của một kim loại có hoá trị II thấy sinh ra kết tủa tan trong dung dịch NaOH dư. Muối sunfat đó là muối nào sau đây?
A. MgSO4. B. CaSO4. C. MnSO4. D. ZnSO4. Câu 22: Dãy nào sau đây sắp xếp các kim loại đúng theo thứ tự tính khử tăng dần?
A. Pb, Ni, Sn, Zn. B. Pb, Sn, Ni, Zn. C. Ni, Sn, Zn, Pb. D. Ni, Zn, Pb, Sn. Câu 23: Sắt tây là sắt được phủ lên bề mặt bởi kim loại nào sau đây?
A. Zn. B. Ni. C. Sn. D. Cr. Câu 24: Cho 19,2 gam kim loại M tác dụng với dung dịch HNO3 loãng, dư thu được 4,48 lít khí duy nhất NO (đktc). Kim loại M là
A. Mg. B. Cu. C. Fe. D. Zn. Câu 25: Cặp chất không xảy ra phản ứng hoá học là A. Cu + dung dịch FeCl3. B. Fe + dung dịch HCl. C. Fe + dung dịch FeCl3. D. Cu + dung dịch FeCl2. Câu 26: Hai kim loại có thể được điều chế bằng phương pháp điện phân dung dịch là A. Al và Mg. B. Na và Fe. C. Cu và Ag. D. Mg và Zn. Câu 27: Cho 7,68 gam Cu tác dụng hết với dung dịch HNO3 loãng thấy có khí NO thoát ra. Khối lượng muối nitrat sinh ra trong dung dịch là
A. 21, 56 gam. B. 21,65 gam. C. 22,56 gam. D. 22,65 gam. Câu 28: Đốt 12,8 gam Cu trong không khí. Hoà tan chất rắn thu được vào dung dịch HNO3 0,5M thấy thoát ra 448 ml khí NO duy nhất (đktc). Thể tích tối thiểu dung dịch HNO3 cần dùng để hoà tan chất rắn là A. 0,84 lít. B. 0,48 lít. C. 0,16 lít. D. 0,42 lít. Câu 29: Khử m gam bột CuO bằng khí H2 ở nhiệt độ cao thu được hỗn hợp chất rắn X. Để hoà tan hết X cần vừa đủ 1 lít dung dịch HNO3 1M, thu được 4,48 lít khí NO duy nhất (đktc). Hiệu suất của phản ứng khử CuO là
A. 70%. B. 75%. C. 80%. D. 85%.
PHÂN BIỆT MỘT SỐ CHẤT VÔ CƠ
Câu 1: Chỉ dùng dung dịch KOH để phân biệt được các chất riêng biệt trong nhóm nào sau đây? A. Zn, Al2O3, Al. B. Mg, K, Na. C. Mg, Al2O3, Al. D. Fe, Al2O3, Mg. Câu 2: Để phân biệt CO2 và SO2 chỉ cần dùng thuốc thử là A. dung dịch Ba(OH)2. B. CaO. C. dung dịch NaOH. D. nước brom. Câu 3: Có 5 dung dịch riêng rẽ, mỗi dung dịch chứa một cation sau đây: NH4+, Mg2+, Fe2+, Fe3+, Al3+ (nồng độ khoảng 0,1M). Dùng dung dịch NaOH cho lần lượt vào từng dung dịch trên, có thể nhận biết tối đa được mấy dung dịch?
A. 2 dung dịch. B. 3 dung dịch. C. 1 dung dịch. D. 5 dung dịch. Câu 4: Có 5 lọ chứa hoá chất mất nhãn, mỗi lọ đựng một trong các dung dịch chứa cation sau (nồng độ mỗi dung dịch khoảng 0,01M): Fe2+, Cu2+, Ag+, Al3+, Fe3+. Chỉ dùng một dung dịch thuốc thử KOH có thể nhận biết được tối đa mấy dung dịch?
A. 2 dung dịch. B. 3 dung dịch. C. 1 dung dịch. D. 5 dung dịch. Câu 5: Có 5 dung dịch hoá chất không nhãn, mỗi dung dịch nồng độ khoảng 0,1M của một trong các muối sau: KCl, Ba(HCO3)2, K2CO3, K2S, K2SO3. Chỉ dùng một dung dịch thuốc thử là dung dịch H2SO4 loãng nhỏ trực tiếp vào mỗi dung dịch thì có thể phân biệt tối đa mấy dung dịch?
A. 1 dung dịch. B. 2 dung dịch. C. 3 dung dịch. D. 5 dung dịch. Câu 6: Khí CO2 có lẫn tạp chất là khí HCl. Để loại trừ tạp chất HCl đó nên cho khí CO2 đi qua dung dịch nào sau đây là tốt nhất?
A. Dung dịch NaOH dư. B. Dung dịch NaHCO3 bão hoà dư.
C. Dung dịch Na2CO3 dư. D. Dung dịch AgNO3 dư. Câu 7: Có các lọ dung dịch hoá chất không nhãn, mỗi lọ đựng dung dịch không màu của các muối sau: Na2SO4, Na3PO4, Na2CO3, Na2S, Na2SO3. Chỉ dùng thuốc thử là dung dịch H2SO4 loãng nhỏ trực tiếp vào mỗi dung dịch thì có thể được các dung dịch
A. Na2CO3, Na2S, Na2SO3. B. Na2CO3, Na2S. C. Na3PO4, Na2CO3, Na2S. D. Na2SO4, Na3PO4, Na2CO3, Na2S, Na2SO3. Câu 8: Có 4 ống nghiệm không nhãn, mỗi ống đựng một trong các dung dịch không màu sau(nồng độ khoảng 0,01M): NaCl, Na2CO3, KHSO4 và CH3NH2. Chỉ dùng giấy quì tím lần lượt nhúng vào từng dung dịch, quan sát sự đổi màu của nó có thể nhận biết được dãy các dung dịch nào?
A. Hai dung dịch NaCl và KHSO4. B. Hai dung dịch CH3NH2 và KHSO4. C. Dung dịch NaCl. D. Ba dung dịch NaCl, Na2CO3 và KHSO4. Câu 9: Để phân biệt dung dịch Cr2(SO4)3 và dung dịch FeCl2 người ta dùng lượng dư dung dịch A. K2SO4. B. KNO3. C. NaNO3. D. NaOH. Câu 10: Có 4 mẫu kim loại là Na, Ca, Al, Fe. Chỉ dùng thêm nước làm thuốc thử có thể nhận biết được tối đa A. 2 chất. B. 3 chất. C. 1 chất. D. 4 chất. Câu 11: Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng và đun nóng, bởi vì: A. tạo ra khí có màu nâu. B. tạo ra dung dịch có màu vàng. C. tạo ra kết tủa có màu vàng. D. tạo ra khí không màu hóa nâu trong không khí. Câu 12: Có 4 dung dịch là: NaOH, H2SO4, HCl, Na2CO3. Chỉ dùng một hóa chất để nhận biết thì dùng chất nào trong số các chất cho dưới đây? A. Dung dịch HNO3 B. Dung dịch KOH. C. Dung dịch BaCl2 D. Dung dịch NaCl. Câu 13: Sục một khí vào nước brom, thấy nước brom bị nhạt màu. Khí đó là A. CO2. B. CO. C. HCl. D. SO2. Câu 14: Khí nào sau có trong không khí đã làm cho các đồ dùng bằng bạc lâu ngày bị xám đen? A. CO2. B. O2. C. H2S. D. SO2. Câu 15: Hỗn hợp khí nào sau đay tồn tại ở bất kỳ điều kiện nào? A. H2 và Cl2. B. N2 và O2. C. HCl và CO2. D. H2 và O2.
HÓA HỌC VÀ VẤN ĐỀ MÔI TRƯỜNG
Câu 1: Hơi thuỷ ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là A. vôi sống. B. cát. C. lưu huỳnh. D. muối ăn. Câu 2: Hiện tượng trái đất nóng lên do hiệu ứng nhà kính chủ yếu là do chất nào sau đây? A. Khí cacbonic. B. Khí clo. C. Khí hidroclorua. D. Khí cacbon oxit. Câu 3: Tỉ lệ số người chết về bệnh phổi do hút thuốc lá gấp hàng chục lần số người không hút thuốc là. Chất gây nghiện và gây ung thư có trong thuốc lá là A. nicotin. B. aspirin. C. cafein. D. moocphin. Câu 4: Tác nhân chủ yếu gây mưa axit là A. CO và CH4. B. CH4 và NH3. C. SO2 và NO2. D. CO và CO2. Câu 5: Không khí trong phòng thí nghiệm bị nhiễm bẩn bởi khí clo. Để khử độc, có thể xịt vào không khí dung dịch nào sau đây? A. Dung dịch HCl. B. Dung dịch NH3. C. Dung dịch H2SO4. D. Dung dịch NaCl. Câu 6: Dẫn không khí bị ô nhiễm đi qua giấy lọc tẩm dung dịch Pb(NO3)2 thấy dung dịch xuất hiện màu đen. Không khí đó đã bị nhiễm bẩn khí nào sau đây? A. Cl2. B. H2S. C. SO2. D. NO2. Câu 7: Dãy gồm các chất và thuốc đều có thể gây nghiện cho con người là A. penixilin, paradol, cocain. B. heroin, seduxen, erythromixin C. cocain, seduxen, cafein. D. ampixilin, erythromixin, cafein. Câu 8: Trong khí thải công nghiệp thường chứa các khí: SO2, NO2, HF. Có thể dùng chất nào (rẻ tiền) sau đây để loại các khí đó? A. NaOH. B. Ca(OH)2. C. HCl. D. NH3.
ĐỀ THI THỬ THPT QUỐC GIA NĂM 2017 Môn: KHOA HỌC TỰ NHIÊN – HÓA HỌC Thời gian làm bài: 50 phút, không kể thời gian phát đề ĐỀ 1 Cho biết nguyên tử khối của các nguyên tố : H =1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S =32; Cl = 35,5; K = 39; Ca = 40; Cr = 52; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba=137. Câu 1: Cacbonhidrat nào có nhiều trong cây mía và củ cải đường ? A. Glucozơ B. Mantozơ C. Fructozơ D. Saccarozơ Câu 2: Cho các kim loại sau: Li, Na, Al, Ca. Số kim loại kiềm trong dãy là: A. 1 B. 3 C. 2 D. 4 Câu 3: Đung nóng 100 gam dung dịch Glucozơ 18% với lượng dư dung dịch AgNO3 trong NH3 đến khi phản ứng xảy ra hoàn toàn thu được m gam Ag. Giá trị của m là: A. 16,2 B. 21,6 C. 10,8 D. 32,4 Câu 4: Loại tơ nào sau đây đốt cháy chỉ thu được CO2 và H2O? A. Tơ olon B. Tơ Lapsan C. Tơ nilon-6,6 D. Tơ tằm Câu 5: Kim loại được dùng phổ biến để tạo trang sức, có tác dụng bảo vệ sức khỏe là: A. Đồng B. Bạc C. Sắt D. Sắt tây Câu 6: Kết luận nào sau đây đúng? A. Điện phân dung dịch CuSO4 với anot đồng, nồng độ Cu2+ trong dung dịch không đổi B. Đốt lá sắt trong khí Cl2 xảy ra ăn mòn điện hóa C. Thanh kẽm nhúng trong dung dịch CuSO4 không xảy ăn mòn điện hóa D. Kim loại có tính khử, nó bị khử thành ion dương. Câu 7: Trong điều kiện thường, chất ở trạng thái khí là: A. etanol B. glyxin C. Metylamin D. anilin Câu 8: Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 loãng thu được V lít H2 (đktc). Giá trị của V là: A. 4,48 lít B. 3,36 lít C. 2,24 lít D. 1,12 lít Câu 9: Phản ứng thủy phân este trong môi trường kiềm gọi là phản ứng A. Este hóa B. Xà phòng hóa C. Tráng gương D. Trùng ngưng Câu 10: Công thức hóa học của sắt (III) hidroxit là: A. Fe2O3 B. Fe(OH)3 C. Fe3O4 D. Fe2(SO4)3 Câu 11: Khi làm thí nghiệm với H2SO4 đặc nóng thường sinh ra khí SO2. Để hạn chế khí SO2 thoát ra gây ô nhiễm môi trường, người ta thường nút ống nghiệm bằng bông tẩm dung dịch. A. Muối ăn B. giấm ăn C. kiềm D. ancol Câu 12: Cho các chất sau: glucozơ, fructozơ, saccarozơ, tinh bột, matri fomat, axit fomic, metyl glicozit. Số chất vừa tham gia phản ứng tráng bạc, vừa làm mất màu nước brom là : A. 5 B. 3 C. 2 D. 4 Câu 13: Để khử mùi tanh của cá (gây ra do một số amin), ta có thể rửa cá với: A. nước B. nước muối C. cồn D. giấm Câu 14: Khi để lâu trong không khí ẩm một vật bằng sắt tây (sắt tráng thiếc) bị sây sát sâu tới lớp sắt bên trong, sẽ xảy ra quá trình A. Sn bị ăn mòn điện hóa. B. Fe bị ăn mòn điện hóa. C. Fe bị ăn mòn hóa học. D. Sn bị ăn mòn hóa học. Câu 15: Chất không thủy phân trong môi trường axit là: A. Glucozơ B. Saccarozơ C. Xenlulozơ D. Tinh bột Câu 16: Có các dung dịch riêng biệt không dán nhãn: NH4Cl, AlCl3, FeCl3, (NH4)2SO4. Dung dịch thuốc thử cần thiết để nhận biết các dung dịch trên là: A. NaOH B. Ba(OH)2 C. NaHSO4 D. BaCl2 Câu 17: Este X có công thức phân tử C2H4O2. Đun nóng 9,0 gam X trong dung dịch NaOH vừa đủ đến khi phản ứng xảy ra hoàn toàn thu được m gam muối. Giá trị của m là: A. 12,3 B. 8,2 C. 15,0 D. 10,2 Câu 18: Đốt cháy hoàn toàn một lượng chất hữu cơ X thu được 3,36 lít khí CO2, 0,56 lít khí N2 (các khí đo ở đktc) và 3,15 gam H2O. Khi X tác dụng với dung dịch BaOH thu được sản phẩm có muối H2N – CH2 – COONa. Công thức cấu tạo thu gọn của X là (cho H = 1, C = 12, O = 16). A. H2N – CH2 – COO – C3H7. B. H2N – CH2 – COO – CH3. C. H2N – CH2 – CH2 – COOH. D. H2N – CH2 – COO – C2H5. Câu 19: Số đồng phân amin bậc 1 của công thức C4H11N là: A. 8 B. 3 C. 4 D. 2 Câu 20: Cho 2,0 gam hỗn hợp X gồm metylamin, đimetylamin phản ứng vừa đủ với 0,05 mol HCl, thu được m gam muối. Giá trị của m là : A. 3,425. B. 4,725. C. 2,550. D. 3,825. Câu 21: Một mẫu khí thải ra được cho qua dung dịch CuSO4, thấy xuất hiện kết tủa màu đen. Hiện tượng này do khí thải có ? A. SO2 B. H2S C. CO2 D. NO2 Câu 22: Protetin tham gia phản ứng màu biure tạo sản phẩm có màu ? A. trắng B. đỏ C. tím D. vàng Câu 23: Phát biểu nào sau đây không đúng ? A. Dùng nước đá khô để bảo quản thực phẩm là phương pháp an toàn nhất B. Dùng nước xử lý các ion kim loại nặng gây ô nhiễm nguồn nước C. Để mắt tránh bị khô do thiếu vitamin A nên ăn cà rốt, gấc, cà chua. D. Các amin đều không độc, được sử dụng để chế biến thực phẩm. Câu 24: Kim loại Ag không tan trong dung dịch: A. HNO3 loãng B. HNO3 đặc nóng C. H2SO4 đặc nóng D. H2SO4 loãng Câu 25: Phương trình hóa học nào sau đây viết sai? A. Cu + 2FeCl3 ® CuCl2 + 2FeCl2. B. Cu + 2AgNO3 ® Cu(NO3)2 + 2Ag. C. Fe + CuCl2 ® FeCl2 + Cu. D. Cu + 2HNO3 ® Cu(NO3)2 + H2. Câu 26: Cho các phát biểu sau về cacbohiđrat: (a) Glucozơ và saccarozơ đều là chất rắn có vị ngọt, dễ tan trong nước. (b) Tinh bột và xenlulozơ đều là polisaccarit. (c) Trong dung dịch, glucozơ và saccarozơ đều hoà tan Cu(OH)2, tạo phức màu xanh lam. (d) Khi thuỷ phân hoàn toàn hỗn hợp gồm tinh bột và saccarozơ trong môi trường axit, chỉthu được một loại monosaccarit duy nhất. (e) Khi đun nóng glucozơ (hoặc fructozơ) với dung dịch AgNO3 trong NH3 thu được Ag. (g) Glucozơ và fructozơ đều tác dụng với H2 (xúc tác Ni, đun nóng) tạo sobitol. Số phát biểu đúng là : A. 5. B. 3. C. 6. D. 4. Câu 27: Đốt cháy hoàn toàn m gam 1 chất béo triglixerit cần 1,61 mol O2, sinh ra 1,14 mol CO2 và 1,06 mol H2O. Cho 7,088 gam chất béo tác dụng vừa đủ với dung dịch NaOH thì khối lượng muối tạo thành là: A. 7,312 gam B. 7,512 gam C. 7,412 gam D. 7,612 gam Câu 28: Cho dãy chất sau: H2NCH(CH3)COOH, C6H5OH (phenol), CH3COOCH3, C2H5OH, CH3NH3Cl. Số chất trong dãy tác dụng được với dung dịch KOH đun nóng là: A. 5 B. 3 C. 4 D. 2 Câu 29: Có 5 dung dịch NH3, HCl, NH4Cl, Na2CO3, CH3COOH cùng nồng độ được đánh ngẫu nhiên là A, B, C, D, E. Giá trị pH và khả năng dẫn điện của dung dịch theo bảng sau: Dung dịch | A | B | C | D | E | pH | 5,25 | 11,53 | 3,01 | 1,25 | 11,00 | Khả năng dẫn điện | Tốt | Tốt | Kém | Tốt | Kém |
Các dung dịch A, B, C, D, E lần lượt là A. NH4Cl, NH3, CH3COOH, HCl, Na2CO3 B. CH3COOH, NH3, NH4Cl, HCl, Na2CO3 C. NH4Cl, Na2CO3, CH3COOH, HCl, NH3 D. Na2CO3, HCl, NH3, NH4Cl, CH3COOH Câu 30: Dung dịch X gồm 0,02 mol Cu(NO3)2 và 0,1 mol H2SO4. Khối lượng Fe tối đa phản ứng được với dung dịch X là (biết NO là sản phẩm khử duy nhất của NO3-). A. 4,48 gam. B. 5,60 gam. C. 3,36 gam. D. 2,24 gam. ` Câu 31: Hòa tan hết 3,264 gam hỗn hợp X gồm FeS2, FeS, Fe, CuS và Cu trong 600ml dung dịch HNO3 1M đung nóng, sau khi kết thúc các phản ứng thu được dung dịch Y và 1,8816 lít (đktc) một chất khí thoát ra. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu được 5,92 gam kết tủa. Mặt khác, dung dịch Y có thể hòa tan tối đa m gam Fe. Biết trong quá trình trên, sản phẩm khử duy nhất của N+5là NO. Giá trị của m là: A. 9,760 B. 9,120 C. 11,712 D. 11,256 Câu 32: Cho 2a mol bột Fe vào dung dịch chứa 5a mol AgNO3, sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch gồm các chất. A. Fe(NO3)3. B. Fe(NO3)2 và Fe(NO3)3. C. Fe(NO3)2, AgNO3. D. Fe(NO3)3 và AgNO3. Câu 33: Đốt cháy hoàn toàn 14,24 gam hỗn hợp X chứa 2 este đều no, đơn chức, mạch hở thu được CO2 và H2O có tổng khối lượng là 34,72 gam. Mặt khác đun nóng 14,24 gam X với dung dịch NaOH vừa đủ, thu được hỗn hợp Y chứa 2 ancol kế tiếp và hỗn hợp Z chứa 2 muối của 2 axit cacboxylic kế tiếp, trong đó có a gam muối A và b gam muối B (MA < MB). Tỉ lệ gần nhất của a : b là A. 0,6 B. 1,25 C. 1,20 D. 1,50 Câu 34: X là một peptit có 16 mắt xích được tạo từ các -amino axit cùng dãy đồng đẳng với glyxin. Để đốt cháy m gam X cần dùng 45,696 lít O2. Nếu cho m gam X tác dụng với lượng vừa đủ dung dịch NaOH rồi cô cạn cẩn thận thì thu được hỗn hợp rắn Y. Đốt cháy Y trong bình chứa 12,5 mol không khí, toàn bộ khí sau phản ứng cháy được ngưng tụ hơi nước thì còn lại 271,936 lít hỗn hợp khí Z. Biết các phản ứng xảy ra hoàn toàn, các khí đo ở đktc, trong không khí có 1/5 thể tích O2 còn lại là N2. Giá trị gần nhất của m là : A. 46 gam B. 41 gam C. 43 gam D. 38 gam Câu 35: Tiến hành các thí nghiệm sau : (a) Cho dung dịch AgNO3 vào dung dịch HCl (b) Cho Al2O3 vào dung dịch HCl loãng dư (c) Cho Cu vào dung dịch HCl đặc nóng dư (d) Cho Ba(OH)2 vào dung dịch KHCO3 Sau khi kết thúc các phản ứng, số thí nghiệm thu được chất rắn là : A. 2 B. 3 C. 1 D. 4 Câu 36: Cho 0,3 mol hỗn hợp X gồm H2NC3H5(COOH)2 (axit glutamic) và (H2N)2C5H9COOH (lysin) vào 400ml dung dịch HCl 0,1 M, thu được dung dịch Y. Biết Y phản ứng với vừa hết 800ml dung dịch NaOH 1M. Số mol lysin trong hỗn hợp X là: A. 0,2 B. 0,25 C. 0,1 D. 0,15 Câu 37: Hỗn hợp M gồm axit cacbonxylic X và este Y (đều đơn chức và cùng số nguyên tử cacbon). Cho m gam M phản ứng vừa đủ với dung dịch chứa 0,25 mol NaOH, sinh ra 18,4 gam hỗn hợp hai muối. Mặt khác, cũng cho m gam M trên tác dụng với lượng dư dung dịch AgNO3 trong NH3 đung nóng kết thúc phản ứng thu được 32,4 gam Ag. Công thức của X và giá trị của m lần lượt là: A. C2H5COOH và 18,5. B. CH3COOH và 15,0. C. C2H3COOH và 18,0 D. HCOOH và 11,5. Câu 38: Hỗn hợp M gồm H2NR(COOH)x và CnH2n+1COOH. Đốt cháy hoàn toàn 0,5 mol M thu được 26,88 lít CO2 (đktc) và 24,3 gam H2O. Mặt khác, cho 0,1 mol M phản ứng vừa đủ với dung dịch chứa a mol HCl. Giá trị của a là: A. 0,06 mol. B. 0,08 mol. C. 0,07 mol. D. 0,05 mol. Câu 39: Cho các phát biểu sau: (1) Cho xenlulozo vào ống nghiệm chứa nước Svayde, khuấy đều thấy xenlulozơ tan ra. (2) Tơ visco, tơ axetat là tơ tổng hợp (3) tơ nitron (hay olon) được dùng để dệt vải may quần áo ấm hoặc bện thành sợi “len” đan áo rét (4) Các hợp chất hữu cơ thường có nhiệt độ nóng chảy, nhiệt độ sôi cao (khó bay hơi) (5) Trong phản ứng tráng gương, glucozo đóng vai trò chất oxi hóa Số phát biểu đúng là : A. 2 B. 3 C. 5 D. 4 Câu 40: Cho m gam hỗn hợp X gồm Fe, Fe3O4 và Fe(NO3)2 tan hết trong 320 ml dung dịch KHSO41M. Sau phản ứng, thu được dung dịch Y chứa 59,04 gam muối trung hòa và 896 ml NO (sản phẩm khử duy nhất của N+5, ở đktc). Y phản ứng vừa đủ với 0,44 mol NaOH. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe(NO3)2 trong X có giá trị gần nhất với giá trị nào sau đây ? A. 63. B. 18. C. 73. D. 20. ----------HẾT----------
PHÂN TÍCH - HƯỚNG DẪN GIẢI Câu 1: Chọn D. Câu 2: Chọn C. Câu 3: Chọn C. - Ta có: nAg = 2nGlucozơ = 0,2 mol Þ mAg = Câu 4: Chọn B. - Các loại tơ olon, tơ nilon-6,6 và tơ tằm trong thành phần có chứa N nên khi đốt cháy hoàn toàn thì có tạo sản phẩm khí N2. Câu 5: Chọn B. - Bạc được ứng dụng rất phổ biến trong việc tạo trang sức, ngoài ra bạc còn có tác dụng bảo vệ sức khỏe của con người. Câu 6: Chọn A. A. Đúng, Khi điện phân dung dịch CuSO4 với anot bằng Cu thì nồng độ của Cu2+ trong dung dịch không đổi: Cu + Cu2+ Cu2+ + Cu B. Sai, Đốt Fe trong khí Cl2 không có tiếp xúc với chất điện li. C. Sai, Thanh kẽm nhúng trong dung dịch CuSO4 có xảy ra ăn mòn điện hóa D. Sai, Kim loại có tính khử, nó bị oxi hóa thành ion dương. Câu 7: Chọn C. Câu 8: Chọn C.
Câu 9: Chọn B. Câu 10: Chọn B. Câu 11: Chọn C. - Để tránh SO2 thoát ra khi cần tẩm bông với kiềm: - Phản ứng tạo muối không bay hơi và không độc như SO2. Câu 12: Chọn B. - Có chất thỏa mãn đề bài là: glucozơ, natri fomat, axit fomic. Câu 13: Chọn D. - Dùng giấm là axit nhẹ để tạo muối với amin, dể rửa trôi. Đồng thời axit yếu nên không ảnh hưởng lớn đến chất lượng thịt cá. Câu 14: Chọn B. - Khi để lâu trong không khí ẩm một vật bằng sắt tây (sắt tráng thiếc) bị sây sát sâu tới lớp sắt bên trong, sẽ xảy ra quá trình Fe bị ăn mòn điện hóa. Câu 15: Chọn A. Câu 16: Chọn B. Thuốc thử | NH4Cl | AlCl3 | FeCl3 | (NH4)2SO4 | Ba(OH)2dùng dư | Có khí mùi khai | Ban đầu có kết tủa trắng keo sau đó tan dần. | Có kết tủa màu nâu đỏ | Vừa có khí mùi khai thoát ra vừa tạo kết tủa trắng |
Câu 17: Chọn D. - Este X chỉ có 1 công thức cấu tạo duy nhất là: HCOOCH3 nên Câu 18: Chọn B. - Khi đốt cháy X tac có: và C = - Khi X tác dụng với NaOH thu được sản phẩm có muối H2N – CH2 – COONa Vậy X là: Câu 19: Chọn C. Bậc của C4H11N | Bậc 1 | Bậc 2 | Bậc 3 | Số đồng phân | 4 | 3 | 1 |
Câu 20: Chọn D.
Câu 21: Chọn B. - Khi cho dung dịch CuSO4 tác dụng với H2S thì thấy có kết tủa CuS màu đen. Câu 22: Chọn C. Câu 23: Chọn D. D. Sai, Các chất khí metyl-, etyl-, đimetyl-, trimetyl- đều là các khí độc; ngoài ra còn có cả anilin cũng là một chất lỏng rất độc. Câu 24: Chọn D. Câu 25: Chọn D. - Phản ứng của Cu và HNO3 không tạo sản phẩm là H2 vì ion H+ không oxi hóa được Cu. Câu 26: Chọn A. - Các phát biểu đúng là: (a), (b), (c), (e), (g); - Phát biểu (d) sai vì thủy phân saccarozơ thu được 2 loại monosaccarit là glucozơ và fructozơ. Câu 27: Chọn A. - Khi đốt cháy chất béo trên thì:
- Xét trong 7,088 gam X thì: Þ mmuối = Câu 28: Chọn C. - Có chất thỏa mãn là: H2NCH(CH3)COOH; C6H5OH; CH3COOC2H5; CH3NH3Cl. Câu 29: Chọn C. - Khả năng dẫn điện phụ thuộc vào khả năng phân ly ra ion của các chất do vậy các chất điện ly tốt thì sẽ dẫn điện tốt và ngược lại. Xét 5 dung dịch trên: · Khả năng dẫn điện tốt: NH4Cl, Na2CO3, HCl · Khả năng dẫn điện kém: NH3, CH3COOH - Giá trị pH các dung dịch theo thứ tự: Na2CO3 > NH3 > NH4Cl > CH3COOH > HCl. Vậy các dung trên là: Dung dịch | NH4Cl (A) | Na2CO3(B) | CH3COOH(C) | HCl (D) | NH3(E) |
Câu 30: Chọn B. Sự oxi hóa | Sự khử | Fe → Fe2+ + 2e (vì lượng Fe phản ứng tối đa nên Fe chuyển lên Fe2+). | 4H+ + NO3- + 3e → NO + 2H2O 0,16 ← 0,04 → 0,12 → 0,04 Cu2+ + 2e → Cu 0,02 → 0,04 2H+(dư) + 2e → H2 0,04 → 0,04 → 0,02 |
Câu 31: Chọn D. - Khi cho Y tác dụng với BaCl2 thì: - Trong Y có:
- Qui hỗn hợp X về Fe, Cu, S thì Vì hòa tan tối đa Fe nên Fe chuyển thành Fe2+. Các quá trình oxi hóa khử: · ; · ; ·
Câu 32: Chọn B. - Vì nên trong dung dịch sau phản ứng chỉ chứa Fe(NO3)2 và Fe(NO3)3. Câu 33: Chọn B. - Khi đốt X chứa 2 este no, đơn chức, mạch hở thì ta luôn có: - Ta có: . Vì khi cho X tác dụng với NaOH thu được 2 ancol kế tiếp và 2 muối của 2 axit cacboxylic kế tiếp nên 2 este trong X lần lượt là: - Hỗn hợp muối Z gồm HCOONa (A): 0,12 mol và CH3COONa (B): 0,08 mol Þ Câu 34: Chọn C. - Ta có: Þ - Xét quá trình đốt hỗn hợp Y. + Ta có: + Khi cho m gam X + NaOH ta có: và mol
Câu 35: Chọn B. - Có phản ứng thu được chất rắn là: (a) (c) Cu không phản ứng với HCl nên sau phản ứng thu được chất rắn là Cu. (d) Câu 36: Chọn A. - Gọi a, b lần lượt là số mol của axit glutamic và lysin, ta có: a + b = 0,3 (1) - Thực hiện gộp quá trình ta suy ra: (2) - Từ (1), (2) ta tính được Câu 37: Chọn B. - Vì M phản ứng với AgNO3/NH3 tạo Ag nên este Y là este của HCOOH (X không thể là HCOOH vì Xvà Y có cùng số nguyên tử C nên số nguyên tử C của Y ít nhất là 2) Þ nY = = 0,15 mol - M phản ứng vừa đủ với 0,25 mol NaOH nên nX = 0,25 - nY = 0,1 mol - Gọi công thức của X là RCOOH thì công thức của Y là HCOOR Þ muối gồn RCOONa và HCOONa. với mmuối = 0,1(R + 67) + 0,15.68 = 18,4 Þ R = 15 là CH3- Vậy X là CH3COOH và Y là HCOOCH3 m = Câu 38: Chọn A. - Nhận thấy: amino axit là no, đơn chức. - Đặt công thức chung của amino axit là CmH2m+1O2N. Khi đốt cháy: - Áp dụng độ bất bão hòa: Vậy 0,1 mol M tác dụng với HCl thì có 0,06 mol amino axit Þ a = Câu 39: Chọn B. - Có phát biểu sai là: (2), (4), (5). (2) Sai, Tơ visco và tơ axetat là tơ bán tổng hợp (4) Sai, Các hợp chất hữu cơ không bền nhiệt, dễ bay hơi, dễ cháy. (5) Sai, Glucozơ trong phản ứng này đóng vai trò là chất khử. Câu 40: Chọn C.
- Ta có:
ĐỀ THI THỬ THPT QUỐC GIA NĂM 2017 Môn: KHOA HỌC TỰ NHIÊN – HÓA HỌC Thời gian làm bài: 50 phút, không kể thời gian phát đề ĐỀ 2 Cho biết nguyên tử khối của các nguyên tố : H =1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S =32; Cl = 35,5; K = 39; Ca = 40; Cr = 52; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba=137. Họ và tên: ……………………………………………….LỚP …………… Cho biết khối lượng nguyên tử (theo u) của các nguyên tố: H = 1; Li = 7; Be =9; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Br = 80; Sr =88; Ag = 108; Ba = 137. Câu 1: Trong các loại tơ dưới đây, chất nào là tơ nhân tạo ? A. Tơ visco. B. Tơ capron. C. Nilon-6,6. D. Tơ tằm. Câu 2: Khi làm thí nghiệm phản ứng của Cu với HNO3 đặc, nóng thường sinh ra khí NO2. Để hạn chế tốt nhất khí NO2 thoát ra gây ô nhiễm môi trường, người ta đậy nút ống nghiệm bằng bông tẩm chất (hoặc dung dịch) nào sau đây ? A. Cồn 75o. B. Giấm ăn (CH3COOH). C. NaOH. D. Nước. Câu 3: Kim loại nào dưới đây không tác dụng với dung dịch HNO3 đặc nguội. A. Cu B. Ag C. Fe D. Mg Câu 4: poli(vinyl clorua) là sản phẩm trùng hợp của: A. CH2=C(CH3)-Cl B. CH2=CH2. C. CH2=CH-Cl. D. C6H5-CH=CH2. Câu 5: Dung dịch etylamin tác dụng được với dung dịch nước của chất nào sau đây? A. NaOH B. NH3 C. NaCl D. FeCl3 và HCl Câu 6. Có bao nhiêu tripeptit (mạch hở) khác loại mà khi thủy phân hoàn toàn đều thu được 3aminoaxit: glyxin, alanin và phenylalanin? A. 6. B. 9. C. 4. D. 3. Câu 7: hòa tan hoàn toàn m gam hỗn hợp ba kim loại Zn, Mg, Fe vào dung dịch HCl thấy thoát ra 2,688 lít khí (đktc). Làm bay hơi dung dịch thu được13,82 gam muối khan. Gía trị của m là: A. 4,37g. B. 2,87. C. 9,56g. D. 5,3g. Câu 8. Cho m gam amin đơn chức bậc một X tác dụng vừa đủ với dung dịch HCl thu được (m+7,3) gam muối. Thể tích dung dịch HCl 2 M đã dùng là : A. 10 ml B. 50 ml C.200 ml D. 100 ml Câu 9. Dung dịch của chất nào sau đây không làm thay đổi màu quỳ tím: A. Glyxin B. Lysin C. Axit glutamic D. Metylamin Câu 10: Thể tích của dung dịch axit nitric 63% (D = 1,4 g/ml) cần vừa đủ để sản xuất được 89,1 kg xenlulozơ trinitrat (hiệu suất 80%) là A. 51,43 lít B. 42,86 lít C. 80,36 lít D. 64,28 lít. Câu 11: Glucozơ không có tính chất nào dưới đây ? A. Tính chất của nhóm anđehit. B. Tính chất của ancol đa chức. C. Tham gia phản ứng thuỷ phân. D. Lên men tạo ancol etylic. Câu 12. Este vinyl axetat có công thức là A. CH3COOCH3. B. CH3COOCH=CH2. C. CH2=CHCOOCH3. D. HCOOCH3. Câu 13: Kim loại X cho vào dung dịch HCl dư thấy không tan. Kim loại X thường dùng làm dây dẫn điện trong các hộ gia đình. Kim loại X là: A. Al B. Fe C. Cu D. Au Câu 14: Thủy phân chất X bằng dung dịch NaOH, thu được hai chất Y và Z đều có phản ứng tráng bạc, Z tác dụng được với Na sinh ra khí H2. Chất X là A. B. C. D. Câu 15: Các tính chất vật lí chung của kim loại như tính dẻo, tính dẫn điện,tính dẫn nhiệt, ánh kim đều được gây ra chủ yếu bởi? A. khối lượng các nguyên tử kim loại B. các electron tự do trong tinh thể C. bán kính nguyên tử các kim loại D. mật độ nguyên tử trong tinh thể Câu 16: Cho các chất sau đây: triolein, etyl axetat, saccarozơ, fructozơ, ala-gly-ala, glucozơ, xenlulozơ, vinyl fomat, anbumin. Số chất bị thủy phân trong môi trường kiềm là A. 8. B. 7. C. 6. D. 5. Bài 17: Xà phòng hóa hoàn toàn 37,38 gam chất béo X bằng dung dịch KOH thu được 3,864 gam glixerol và m gam xà phòng .Giá trị của m là A.21,78 gam B.37,516 gam C.38,556 gam D.39,06 gam Câu 18: Hòa tan hết 1 lượng Na vào dung dịch HCl 10% thu được 59,15 gam dung dịch gồm NaCl và NaOH và 2,24 lít H2(đktc). Nồng độ % NaCl trong dung dịch thu được là : A. 12,48 B. 15,38 C. 14,83 D. 12,68 Câu 19: Nhận định nào sau đây là sai? A. Thủy phân chất béo trong môi trường axit hay kiềm đều thu được glyxerol. B. Glucozơ và fructozơ đều hòa tan được Cu(OH)2 ở nhiệt độ thường tạo phức xanh lam. C. Dùng nước Br2 có thể phân biệt được glucozơ và fructozơ. D. Etyl propionat và propyl fomat là đồng phân của nhau. Câu 20. Khí nào sau đây gây ra hiện tượng mưa axit: A. NH3. B. CO2. C. CH4. D. SO2. Câu 21: Để khử mùi tanh của cá (gây ra do một số amin) ta có thể rửa cá với chất nào sau đây? A. Giấm. B. Nước vôi trong. C. Nước muối. D. Nước cất. Câu 22: Este X đơn chức, chứa vòng benzen. Trong X thì oxi chiếm 23,53 % về khối lượng. Thủy phân hoàn toàn 10,88 gam X trong NaOH dư thu được m gam muối. Gía trị của m không thể là: A. 15,84. B. 11,52. C. 17,28. D. 5,44 Câu 23: Cho 3,0 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 2,8 lít H2 (ở đktc). Kim loại đó là: A. Ca. B. Mg. C. Ba. D. Sr. Câu 24: Khi xà phòng hóa tristearin thu được sản phẩm là. A. C17H35COONa và glixerol. B.C15H31COOH và glixerol. C. C17H35COOH và glixerol. D. C15H33COONa và glixerol. Câu 25: Nhúng 1 thanh nhôm nặng 45 gam vào dung dịch CuSO4. Sau một thời gian lấy thanh nhôm ra cân lại thấy nặng 46,38 gam. Khối lượng Cu thoát ra là: A. 0,64 gam. B. 1,28 gam. C. 2,56 gam. D. 1,92 gam. Câu 26: Dẫn hỗn hợp khí gồm CO2, O2, N2 và H2, NO2, H2S qua dung dịch NaOH. Số khí bị hấp thụ là A. 2 B.3 C.4 D. 5 Bài 27: Thủy phân hoàn toàn 10,75 gam một este X trong NaOH dư , thu được 11,75 gam muối .Mặt khác ,cũng 10,75 gam X có thể làm mất màu vừa hết 100 gam dung dịch Br2 20% .Biết rằng trong phân tử X có chứa 2 liên kết .Tên gọi của X là A.Metyl ađipat B.Vinyl axetat C.Vinyl propionat D.Metyl acrylat Câu 28: Có thể phân biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là A. giấy quì tím. B. BaCO3. C. Al. D. Zn. Câu 29. Hỗn hợp X gồm một số amino axit (chỉ chứa nhóm chức –COOH và –NH2 trong phân tử), trong đó tỉ lệ mO: mN = 16:7. Để tác dụng vừa đủ với 10,36 gam hỗn hợp X cần vừa đúng 120 ml dung dịch HCl 1M. Mặt khác cho 10,36 gam hỗn hợp X tác dụng với 150 ml dung dịch NaOH 1M rồi cô cạn thu được m gam rắn. Giá trị của m là A. 13,84. B. 16,36. C. 14,56. D. 14,20. Câu 30: Dãy gồm các kim loại đều phản ứng với H2O ở nhiệt độ thường là A. Ba, Na, Cu. B. Na, Ba, Ag. C. Na, Ca, K. D. Ba, Fe, K. Câu 31: Cho phản ứng: Cu + HNO3 → Cu(NO3)2 + NO + H2O. Khi hệ số cân bằng phản ứng là nguyên và tối giản thì số phân tử HNO3 bị khử là A. 6. B. 2. C. 11. D. 8. Câu 32: Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình bên. Giá trị của x là A. 0,60 mol. B. 0,50 mol. C. 0,42 mol. D. 0,62 mol. |
|
Câu 33: Cho 60 gam hỗn hợp Cu và CuO tan hết trong dung dịch HNO3 loãng dư thu được 13,44 lit khí NO (đktc, sản phẩm khử duy nhất). Phần % về khối lượng của Cu trong hỗn hợp là: A. 69%. B. 96%. C. 44% D. 56%. Câu 34: Hòa tan hỗn hợp A gồm Fe, FeO, Fe2O3, Fe3O4, Fe(OH)2, Fe(OH)3, FeCO3 trong dung dịch HCl dư thu được 2,688 lít (đktc) hỗn hợp khí có tỉ khối so với He bằng 5,75 và dung dịch chứa m gam muối. Mặt khác hòa tan hoàn toàn lượng hỗn hợp rắn A như trên trong dung dịch HNO3 dư thu được dung dịch X chứa 96,8 gam một muối và 4,48 lít (đktc) gồm 2 khí, trong đó có một khí hóa nâu trong không khí. Giá trị của m là A. 29,660. B. 54,350. C. 27,175. D. 59,320. Câu 35: Hiện tượng xảy ra khi cho Na kim loại vào dung dịch CuSO4 là: A. sủi bọt khí không màu và có kết tủa màu xanh, dung dịch nhạt màu. B. bề mặt kim loại có màu đỏ, dung dịch nhạt màu. C. sủi bọt khí không màu và có kết tủa màu đỏ. D. bề mặt kim loại có màu đỏ và có kết tủa màu xanh. Câu 36: Có 500 ml dung dịch X chứa Na+, NH4+, CO32- và SO42-. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu được 2,24 lít khí. Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thu được 43 gam kết tủa. Lấy 200 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu được 8,96 lít khí NH3. Các phản ứng hoàn toàn, các thể tích khí đều đo ở đktc. Tính tổng khối lượng muối có trong 300 ml dung dịch X ? A. 71,4 gam. B. 23,8 gam. C. 86,2 gam. D.119 gam. Câu 37: Đun nóng 0,4 mol hỗn hợp E gồm 3 peptit mạch hở X, Y, Z cần dùng vừa đủ 700 ml dung dịch NaOH 2M, sau phản ứng thu được dung dịch chứa hỗn hợp T chỉ gồm các muối của glyxin, alanin và valin (trong đó số muối của alanin chiếm 55,639 % về khối lượng). Mặt khác đốt cháy hoàn toàn 55,4 gam E bằng O2 vừa đủ rồi dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch Ca(OH)2 thấy bình tăng 136,8 gam. Phần trăm khối lượng muối của valin trong hỗn hợp T gần nhất với giá trị nào dưới đây? A. 27%. B. 26%. C. 28%. D. 25%. Câu 38: X là este no, 2 chức; Y là este tạo bởi glyxerol và một axit cacboxylic đơn chức, không no chứa một liên kết C=C (X, Y đều mạch hở và không chứa nhóm chức khác). Đốt cháy hoàn toàn 17,02 gam hỗn hợp E chứa X, Y thu được 18,144 lít CO2 (đktc). Mặt khác đun nóng 0,12 mol E với cần dùng 570 ml dung dịch NaOH 0,5M; cô cạn dung dịch sau phản ứng thu được hỗn hợp chứa 3 muối có khối lượng m gam và hỗn hợp 2 ancol có cùng số nguyên tử cacbon. Giá trị gần nhất của m là. A. 26,9gam B. 27,50gam C. 19,63 gam D. 28,14 gam Câu 39: Hỗn hợp E gồm chất X (CH8N4O6) và chất Y (C7H13N3O4), trong đó Y là tripeptit. Cho 19,968 gam E tác dụng với dung dịch NaOH dư, đun nóng thu được 0,05 mol một chất hữu cơ đa chức làm xanh quỳ tím ẩm và dung dịch A. Cô cạn dung dịch A thu được m gam muối khan. Giá trị của m là
A. 26,588 B. 22,338 C. 21,330 D. 25,580 Câu 40: Hòa tan hoàn toàn hỗn hợp X gồm Al; ZnO; Fe3O4 và Fe(NO3)2 (trong đó oxi chiếm 27,08% theo khối lượng) trong dung dịch HCl dư thấy có 2,78 mol HCl phản ứng, thu được 6,048 lít (đkc) hỗn hợp NO; H2 có tỉ khối hơi so với H2 là 65/9 và dung dịch chứa 149,03 gam muối ( không chứa muối Fe3+) . Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Al trong X gần nhất với giá trị nào dưới đây? A. 15%. B. 19%. C. 23%. D. 8%. | KỲ THI THỬ THPT QG LẦN I NĂM HỌC 2016-2017 | | ĐÁP ÁN MÔN: HÓA HỌC |
Câu | MÃ ĐỀ | 132 | 209 | 357 | 485 | 1 | D | D | C | A | 2 | C | C | B | C | 3 | C | D | C | C | 4 | A | A | D | C | 5 | C | A | B | D | 6 | A | B | D | A | 7 | D | B | A | D | 8 | D | D | B | D | 9 | C | C | D | A | 10 | A | D | A | C | 11 | C | D | C | C | 12 | D | B | D | B | 13 | B | D | A | C | 14 | A | A | A | A | 15 | C | C | D | B | 16 | D | C | B | D | 17 | C | B | C | C | 18 | D | C | C | C | 19 | C | B | D | D | 20 | D | A | B | D | 21 | C | A | C | A | 22 | B | A | B | C | 23 | B | C | A | B | 24 | B | C | C | A | 25 | A | C | A | D | 26 | A | C | B | B | 27 | B | D | A | D | 28 | C | A | C | B | 29 | B | D | D | D | 30 | A | B | D | C | 31 | B | A | A | B | 32 | B | B | C | A | 33 | D | B | B | B | 34 | B | B | A | B | 35 | A | D | B | A | 36 | D | A | D | A | 37 | D | C | A | B | 38 | A | B | B | A | 39 | A | D | D | D | 40 | B | A | C | B |
ĐỀ THI THỬ THPT QUỐC GIA NĂM 2017 Môn: KHOA HỌC TỰ NHIÊN – HÓA HỌC Thời gian làm bài: 50 phút, không kể thời gian phát đề ĐỀ 3 Cho biết nguyên tử khối của các nguyên tố : H =1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S =32; Cl = 35,5; K = 39; Ca = 40; Cr = 52; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba=137. Câu 1: Sản phẩm của phản ứng nhiệt nhôm luôn có A. Al. B. Al(OH)3. C. Al2O3 D. O2. Câu 2: Chất nào sau đây vừa tác dụng với dung dịch HCl vừa tác dụng với dung dịch AgNO3? A. Cu. B. Al2O3. C. FeO. D. Fe(NO3)2. Câu 3: Để phân biệt dung dịch BaCl2 với dung dịch NaCl, người ta dùng dung dịch A. HNO3. B. Na2CO3. C. NaNO3. D. KNO3. Câu 4: Chất nào sau đây không có tính chất lưỡng tính? A. Cr(OH)3. B. CrO3. C. Al2O3. D. Al(OH)3. Câu 5: Trong công nghiệp, quặng boxit dùng để điều chế kim loại nào sau đây? A. Ba. B. Cu. C. Al. D. Mg. Câu 6: Trong công nghiệp sản suất gang, chất nào sau đây dùng để khử oxit ở nhiệt độ cao? A. H2. B. Al. C. CO. D. Na. Câu 7: Oxit nào sau đây bị oxi hóa khi phản ứng với dung dịch HNO3 loãng? A. CuO. B. MgO. C. Al2O3. D. Fe3O4. Câu 8: Nguyên tố hóa học nào sau đây thuộc nhóm kim loại kiềm thổ? A. Nhôm. B. Magie. C. Natri. D. Kali. Câu 9:Trong trường hợp nào sau đây không có sự đổi màu xảy ra? A. Cho dung dịch KOH vào dung dịch K2Cr2O7. B. Cho dung dịch FeSO4 vào dung dịch hỗn hợp chứa H2SO4 và K2Cr2O7. C. Cho dung dịch H2SO4 vào dung dịch K2CrO4. D. Cho dung dịch H2SO4 vào dung dịch K2Cr2O7. Câu 10: Trong các chất sau đây, chất nào tác dụng được với dung dịch FeCl3? A. FeCl2 B. Cu C. Ag D. Ag2O Câu 11: Thêm dung dịch NaOH dư vào dung dịch chứa 0,3 mol Fe(NO3)3. Lọc kết tủa, đem nung đến khối lượng không đổi thì khối lượng chất rắn thu được là: A. 96,0 gam. B. 24,0 gam. C. 32,1 gam. D. 48,0 gam. Câu 12: Một mẫu kim loại Ag có lẫn Cu, Fe. Để loại bỏ tạp chất của mẫu Ag trên người ta dung dịch nào sau đây? A. FeCl3. B. HNO3. C. HCl. D. CuCl2. Câu 13: Để loại bỏ lớp cặn trong ấm đun sôi nước lâu ngày, người ta có thể dùng dung dịch nào sau đây? A. Giấm ăn. B. Nước vôi. C. Cồn 700. D. Muối ăn. Câu 14: Phát biểu nào sau đây không đúng? A. Nhôm là kim loại nhẹ, dẫn điện, dẫn nhiệt tốt. B. Nhôm bị phá hủy trong môi trường kiềm. C. Nhôm có tính khử mạnh chỉ sau kim loại kiềm và kiềm thổ trong cùng chu kì. D. Nhôm phản ứng được với H2SO4 đặc nguội. Câu 15: Kim loại sắt tác dụng với chất nào sau đây tạo ra muối sắt (II)? A. H2SO4 đặc nóng, dư. B. CuSO4. C. MgSO4. D. HNO3 đặc, nóng, dư. Câu 16: Có các kim loại sau: Ni, Zn, Sn, Cu. Trong thực tế kim loại nào được dùng để bảo vệ điện hóa vỏ tàu biển? A. Zn. B. Sn. C. Cu. D. Ni. Câu 17: Nhỏ từ từ dung dịch NaOH đến dư vào dung dịch X. Sau khi các phản ứng xảy ra hoàn toàn chỉ thu được dung dịch trong suốt. Chất tan có trong dung dịch X là A. Fe(NO3)3. B. CuSO4. C. AlCl3. D. Ca(HCO3)2. Câu 18: Phát biểu nào sau đây không đúng? A. NaOH dùng để nấu xà phòng. B. Na2CO3 dùng trong công nghiệp nấu thủy tinh, phẩm nhuộm. C. CaCO3 dùng để nặn tượng, đúc khuôn và bó bột khi gẫy xương. D. NaHCO3 dùng trong công nghiệm thực phẩm. Câu 19: Một hợp kim của Fe với cacbon trong đó có từ 0,01 - 2% khối lượng cacbon, có ít Si, Mn và rất ít S, P. Hợp kim đó là: A. gang trắng. B. gang xám. C. thép thường. D. thép đặc biệt. Câu 20: Dung dịch nào sau đây có thể phân biệt 2 khí SO2 và CO2? A. Nước brom. B. Ca(OH)2. C. NaOH. D. HCl. Câu 21: Cho V lít CO2 đkc hấp thụ hết trong dung dịch chứa 0,2 mol Ba(OH)2 và 0,1 mol NaOH. Sau phản ứng hoàn toàn thì được kết tủa và dung dịch chứa 21,35 gam muối.V có giá trị là A. 8,4l B. 6,72l C. 7,84l D. 8,96l Câu 22: Dẫn V lít CO2 (đkc). vào 300ml dd Ca(OH)2 0,5 M. Sau phản ứng được 10g kết tủa. V bằng: A. 4,48 lít (3) B. Cả (1), (3) đều đúng C. 2,24 lít (1) D. 3,36 lít (2) Câu 23: Hấp thụ toàn bộ x mol CO2 vào dung dịch chứa 0,03 mol Ca(OH)2 được 2 gam kết tủa. gía trị x? A. 0,01mol và 0,03 mol B. 0,03mol và 0,04 mol C. 0,02mol và 0,05 mol D. 0,02mol và 0,04 mol. Câu 24: Sục 6,72 lít khí CO2 (đktc) vào dung dịch có chứa 0,25 mol Ca(OH)2. Kết thúc phản ứng khối lượng kết tủa thu được là A. 15 gam. B. 25 gam. C. 20 gam. D. 30 gam. Câu 25: Cho Fe dư vào dung dịch H2SO4 loãng thu được 6,72 lít khí ở điều kiện tiêu chuẩn. Khối lượng sắt tham gia phản ứng là A. 16,8 gam. B. 5,6 gam. C. 25,2 gam. D. 11,2 gam. Câu 26: Nhúng thanh sắt có khối lượng 56 gam vào 200 ml dung dịch CuSO4. Khi phản ứng xong lấy thanh sắt đem cân thấy nặng 56,4 gam. Nồng độ mol/l dung dịch CuSO4 đã dùng là A. 0,5 M. B. 0,25 M. C. 0,75 M. D. 1,0 M. Câu 27: Dung dịch NaOH có thể tác dụng với tất cả các chất nào sau đây? A. Al, HCl, CaCO3. B. FeCl3, HCl, Ca(OH)2. C. FeCl2, Al(OH)3, HCl. D. CuSO4, Ba(OH)2, H2SO4. Câu 28: Phát biểu nào sau đây không đúng? A. Vật làm bằng nhôm có thể hòa tan trong nước ở nhiệt độ cao. B. Nhôm tan được trong dung dịch axit mạnh và ba zơ mạnh. C. Al(OH)3 là hợp chất không bền bởi nhiệt. D. Nhôm oxit là hợp chất bền bởi nhiệt. Câu 29: Thuốc thử nào trong các thuốc thử dưới đây có thể dùng để nhận biết được tất cả các dung dịch các chất sau: Glucozơ, glixerol, fomanđehit, etanol? A. Na kim loại B. Nước brom C. [Ag(NH3)2]OH D. Cu(OH)2 trong môi trường kiềm Câu 30: Có bao nhiêu trieste được tạo nên khi cho glixerin tác dụng với axit panmitic và axit oleic. A. 8. B. 4. C. 6. D. 10. Câu 31: Thêm 150ml dung dịch NaOH 2M vào một cốc đựng 100ml dung dịch AlCl3 nồng độ x mol/l, sau khi phản ứng hoàn toàn thấy trong cốc có 0,1 mol chất kết tủa. Thêm tiếp 100ml dung dịch NaOH 2M vào cốc, sau khi phản ứng hoàn toàn thấy trong cốc có 0,14 mol chất kết tủa. Tính x. A. 1,0M B. 1,6M C. 0,8M D. 2,0M Câu 32: Để khử hoàn toàn 30 gam hỗn hợp gồm CuO, Fe2O3, Fe, MgO cần dùng 5,6 lít khí CO (đktc). Khối lượng chất rắn thu được là A. 28 gam. B. 26 gam. C. 24 gam. D. 22 gam. Câu 33: Cho dung dịch NaOH (dư) vào dung dịch chứa hỗn hợp MgCl2 và AlCl3, thu được kết tủa X. Nung X trong không khí đến khối lượng không đổi thu được chất rắn Y. Chất rắn Y là A. Cr2O3. B. CrO. C. MgO và Cr2O3. D. MgO. Câu 34: Thể tích khí NO (sản phẩm khử duy nhất ở điều kiện tiêu chuẩn) thu được khi hòa tan hoàn toàn 19,2 gam Cu trong dung dịch HNO3 là A. 6,72 lít. B. 8,96 lít. C. 2,24 lít. D. 4,48 lít. Câu 35: Hiện tượng nào dưới đây được mô tả không đúng? A. Dung dịch H2SO4 hòa tan Fe(OH)3. B. Cho bột Fe vào dung dịch NaOH thấy có khí thoát ra. C. Thêm dung dịch NaOH vào dung dịch FeCl3 thấy xuất hiện kết tủa đỏ nâu. D. Thêm Cu vào dung dịch Fe(NO3)3 thấy dung dịch chuyển từ màu vàng nâu sang màu xanh. Câu 36: Cho 200g dung dịch glucozơ tác dụng với một lượng Ag2O trong amoniac thu được 8,64g kết tủa. Nồng độ C% của glucozơ trong dung dịch bằng bao nhiêu? A. 1,8% B. 2,4% C. 3,6% D. 7,2% Câu 37: X là một este đơn chức. Thủy phân 0,01 mol este X với 300 ml NaOH 0,1M đến khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y thu được một phần hơi (chỉ chứa nước) và 2,38 gam rắn khan. Số công thức cấu tạo có thể có của este X là: A. 1 B. 3 C. 2 D. 4 Câu 38: Trường hợp nào sau đây thu được kết tủa sau khi kết thúc phản ứng: A.Dung dịch NaOH dư tác dụng với dung dịch FeCl2 B.Dung dịch NaOH dư tác dụng với dung dịch Cr(NO3)3 C.Dung dịch HCl dư tác dụng với dung dịch NaAlO2 D.CO2 dư tác dụng với dung dịch Ca(OH)2 Câu 39: Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,80 lít khí CO2 ; 2,80 lít N2 (các thể tích đo ở đktc) và 20,25 gam H2O. CTPT của X là: A. C3H9N. B. C4H9N. C. C3H7N. D. C2H7N. Câu 40: Hòa tan hoàn toàn 1,2 gam Mg bằng dung dịch H2SO4 loãng, thu được V lít H2 (đktc). Giá trị của V là A. 2,24. B. 3,36. C. 1,12. D. 4,48. Câu | Đáp án | Lời giải ngắn, rõ | 1 | C | Al2O3 | 2 | D | Fe(NO3)2. | 3 | B | Na2CO3. | 4 | B | CrO3. | 5 | C | Al. | 6 | C | CO. | 7 | D | Fe3O4. | 8 | B | Magie. | 9 | D | Cho dung dịch H2SO4 vào dung dịch K2Cr2O7 thì màu cam không đổi. | 10 | B | Cu | 11 | B | Số mol Fe2O3 = 0,3/2 = 0,15 mol m↓ = 0,15 . 160 = 24,0 gam. | 12 | A | FeCl3. | 13 | A | Giấm ăn. | 14 | D | Nhôm phản ứng được với H2SO4 đặc nguội. | 15 | B | CuSO4. | 16 | A | Zn. | 17 | C | AlCl3. | 18 | C | CaCO3 dùng để nặn tượng, đúc khuôn và bó bột khi gẫy xương. | 19 | C | thép thường. | 20 | A | Nước brom. | 21 | C | 2 muốiđó là NaHCO3 (0,1 mol) và Ba(HCO3)2 (x mol) Suy ra x = 0,05 => n↓ =0,2 – 0,05 = 0,15 mol BaCO3 nCO2 = 0,1 + 0,05.2 + 0,15 = 0,35 mol =>V = 7,84 lít | 22 | B | Cả (1), (3) đều đúng | 23 | D | TH1: nCO2 = n↓ = 0,02 mol TH2: nCO2 = 2nCa2+ - n↓ = 2.0,03 – 0,02 = 0,04 mol. | 24 | C | nCO2 = 2nCa2+ - n↓ ó0,3 = 2.0,25 – n↓ => n↓ = 0,2 mol m↓ = 0,2 . 100 = 20 gam. | 25 | A | 16,8 gam. | 26 | B | 0,25 M. | 27 | C | FeCl2, Al(OH)3, HCl. | 28 | A | Vật làm bằng nhôm có thể hòa tan trong nước ở nhiệt độ cao. | 29 | D | Cu(OH)2 trong môi trường kiềm | 30 | C | 6. | 31 | B | nOH = 4nAl3+ - n↓ ó 0,25.2 = 4. nAl3+ - 0,14 ó nAl3+ = 0,16 mol => V = 0,16/0,1 = 1,6 M | 32 | B | m ↓ = mhh – 16nCO = 30 – 0,25.16 = 26 gam. | 33 | D | MgO. | 34 | D | 4,48 lít. | 35 | B | Cho bột Fe vào dung dịch NaOH thấy có khí thoát ra. | 36 | C | C% = (8,64/108)/2 . 180/200 . 100 = 3,6% | 37 | D | 4 | 38 | A | Dung dịch NaOH dư tác dụng với dung dịch FeCl2 | 39 | A | C3H9N. | 40 | C | nH2 = nMg = 1,2/24 = 0,05 mol => V = 0,05 . 22,4 = 1,12 lít. |
ĐỀ THI THỬ THPT QUỐC GIA NĂM 2017 Môn: KHOA HỌC TỰ NHIÊN – HÓA HỌC Thời gian làm bài: 50 phút, không kể thời gian phát đề ĐỀ 4 Cho biết nguyên tử khối của các nguyên tố : H =1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S =32; Cl = 35,5; K = 39; Ca = 40; Cr = 52; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba=137. Câu 1: Phát biểu nào sau đây không đúng về xà phòng và chất tẩy rửa tổng hợp? A. Đều được sản xuất bằng cách đun nóng chất béo với dung dịch kiềm. B. Chất tẩy rửa tổng hợp không phải là muối natri của axit cacboxylic, ít bị kết tủa trong nước cứng. C. Chất tẩy rửa tổng hợp không phải là muối natri của axit cacboxylic, ít bị kết tủa trong nước cứng. D. Đều có khả năng hoạt động bề mặt cao, có tác dụng làm giảm sức căng bề mặt chất bẩn. Câu 2: Trong các pháp biểu sau về độ cứng của nước: (1) Khi đun sôi ta có thể loại được độ cứng tạm thời của nước. (2) Có thể dùng Na2CO3 để loại cả độ cứng tạm thời và độ cứng vĩnh cửu của nước. (3) Có thể dùng HCl để loại độ cứng của nước. (4) Có thể dùng Ca(OH)2 với lượng vừa đủ để loại độ cứng của nước. Chọn pháp biểu đúng: A. (1) và (2). B. Chỉ có 4. C. (1), (2) và (4). D. Chỉ có 2 Câu 3: Hiđro hoá cao su Buna thu được một polime có chứa 11,765% hiđro về khối lượng, trung bình một phân tử H2 phản ứng được với k mắt xích trong mạch cao su. Giá trị của k là A. 4 B. 5 C. 2 D. 3 Câu 4: Polime dùng làm ống dẫn nước, đồ giả da, vải che mưa là A. PP. B. PS. C. PVA. D. PVC. Câu 5: Để phân biệt xà phòng, hồ tinh bột, lòng trắng trứng ta sẽ dùng thuốc thử nào sau đây? A. Chỉ dùng Cu(OH)2 B. Kết hợp I2 và AgNO3/NH3. C. Kết hợp I2 và Cu(OH)2. D. Chỉ dùng I2. Câu 6: Suất điện động chuẩn của pin điện hoá Mn–Cd là +0,79V và thế điện cực chuẩn của cặp Cd2+/Cd là – 0,40V. Thế điện cực chuẩn của cặp Mn2+/Mn là: A. +0,39V. B. +0,39V. C. –1,19V. D. +1,19V. Câu 9: Để điều chế cao su Buna người ta có thể thực hiện theo các sơ đồ biến hóa sau:
Tính khối lượng etan cần lấy để có thể điều chế được 5,4 kg cao su buna theo sơ đồ trên?
A. 46,875 kg. B. 62,50 kg. C. 15,625 kg. D. 31,25 kg. Câu 10: Lysin là chất có công thức phân tử là A. C5H11O2N B. C6H14O2N2 C. C9H11O3N D. C5H9O4N Câu 11: Cho 45 gam axit axetic phản ứng với 69 gam etanol (có H2SO4 đặc làm xúc tác) đun nóng, thu được 41,25 gam este. Hiệu suất của phản ứng este hoá là : A. 31,25%. B. 40,00%. C. 50,00%. D. 62,50%. Câu 12: Thủy phân hoàn toàn 4,34 gam tripeptit mạch hở X (được tạo nên từ hai α-amino axit có cùng công thức dạng H2NCxHyCOOH) bằng dung dịch NaOH dư, thu được 6,38 gam muối. Mặt khác thủy phân hoàn toàn 4,34 gam X bằng dung dịch HCl dư, thu được m gam muối. Giá trị của m là A. 7,25. B. 8,25. C. 5,06 D. 6,53. Câu 15: Hoà tan m gam hỗn hợp Ba, Al vào nước thu được dung dịch X chỉ chứa một chất tan duy nhất và 12,544 lít H2 (đktc), không còn chất rắn không tan. Thổi CO2 dư vào dung dịch X thu được kết tủa Y và dung dịch Z. Đun nóng dung dịch Z đến khi phản ứng kết thúc thu được kết tủa T. Lấy kết tủa Y trộn với kết tủa T rồi nung trong không khí đến khối lượng không đổi thu được chất rắn Q. Khối lượng của Q là A. 35,70g B. 39,78g C. 38,25g D. 38,25g Câu 16: Trong nước tiểu của người bị bệnh tiểu đường có chứa một lượng nhỏ glucozơ. Phản ứng nào sau đây để nhận biết sự có mặt glucozơ có trong nước tiểu? A. Cu(OH)2 hay H2/Ni,t0 B. NaOH hay [Ag(NH3)2]OH C. Cu(OH)2 hay Na D. Cu(OH)2 hay [Ag(NH3)2]OH Câu 17: Thực hiện các thí nghiệm sau: (I) Cho dung dịch NaCl vào dung dịch KOH. (II) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2. (III) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn. (IV) Cho Cu(OH)2 vào dung dịch NaNO3. (V) Sục khí NH3 vào dung dịch Na2CO3. (VI) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2. Số thí nghiệm điều chế được NaOH là A. 5 B. 2 C. 4 D. 3 Câu 22: Ứng dụng nào sau đây không phải của kim loại kiềm? A. Dùng điều chế Al trong công nghiệp hiện nay. B. Tạo hợp kim có nhiệt độ nóng chảy thấp, dùng trong thiết bị báo cháy. C. Na, K dùng làm chất trao đổi nhiệt ở một vài phản ứng hạt nhân. D. Dùng trong phản ứng hữu cơ. Câu 23: Cho các chất sau: (1) Cl2; (2) I2; (3) HNO3; (4) H2SO4 đặc, nguội. Khi cho Fe tác dụng với lượng dư các chất trên, chất nào trong số các chất trên đều tạo được hợp chất trong đó sắt có hóa trị III? A. (1), (2) B. (1), (2), (3) C. (1), (3) D. (1), (3), (4) Câu 24: Đốt cháy hoàn toàn 0,2 mol este đơn chức X rồi cho sản phẩm cháy lần lượt qua bình 1 đựng 100 gam dung dịch H2SO4 96,48%; bình 2 đựng dung dịch KOH dư. Sau thí nghiệm thấy nồng độ H2SO4 ở bình 1 giảm còn 87,08%; bình 2 có 82,8 gam muối. Công thức phân tử của X là A. C3H4O2. B. C2H4O2. C. C3H6O2. D. C4H8O2. Câu 25: Thực hiện phản ứng nhiệt nhôm m gam hỗn hợp gồm Al và Fe3O4. Để hoà tan hết các chất tan được trong dung dịch KOH thì cần dùng 400g dung dịch KOH 11,2%, không có khí thoát ra. Sau khi hoà tan bằng dung dịch KOH, phần chất rắn còn lại có khối lượng 73,6g. Giá trị của m là A. 114,4g B. 103,6g C. 91,2g D. 69,6g Câu 26: Metylpropionat là tên gọi của: A. HCOOCH3. B. C2H5COOH C. C2H5COOCH3. D. C2H5COOC2H5. Câu 27: Nếu thuỷ phân không hoàn toàn pentapeptit Gly-Ala-Val-Ala-Val-Ala thì thu được tối đa bao nhiêu tripeptit khác nhau? A. 3 B. 4 C. 1 D. 2 Câu 28: Để tráng bạc một số ruột phích, người ta thủy phân 171 gam saccarozơ trong môi trường axit. Dung dịch thu được cho phản ứng với dung dịch AgNO3 dư. Tính khối lượng Ag tạo ra là (giả thiết rằng hiệu xuất các phản ứng đều đạt 90%) A. 97,2 gam B. 194,4 gam C. 87,48 gam D. 174,96 gam Câu 29: Khi nhỏ từ từ đến dư dung dịch KOH vào dung dịch hỗn hợp chứa AlCl3 và HCl, kết quả thí nghiệm được biểu diễn trên đồ thị sau (số liệu tính theo đơn vị mol):
Tỷ lệ x : a xấp xỉ là A. 3,6 B. 3,5 C. 4,1 D. 3,7 Câu 30: Cho biết Cu có Z=29. Cấu hình electron của Cu+ là A. [Ar]3d10 B. [Ar]3d84s2 C. [Ar]3d94s1 D. [Ar]4s23d8 Câu 31: Cho 1,68 gam hỗn hơp A gồm Fe, Cu, Mg tác duṇ g hết với H2SO4 đăc nóng. Sau phản ứng thấy tao hỗn hơp muối B và khí SO2 có thể tích 1,008 lít (đktc). Khối lươṇg muối thu đươc là A. 7 gam. B. 5,9 gam. C. 6 gam D. 6,5 gam. Câu 32: Trong ba oxit CrO, Cr2O3, CrO3. Thứ tự các oxit chỉ tác dụng với dung dịch bazơ, dung dịch axit, dung dịch axit và dung dịch bazơ lần lượt là A. Cr2O3, CrO, CrO3 B. CrO3, CrO, Cr2O3 C. CrO, Cr2O3, CrO3 D. CrO3, Cr2O3, CrO Câu 34: Hỗn hợp E chứa 3 peptit X, Y, Z (MX < MY < MZ) đều mạch hở có tổng số nguyên tử oxi là 14 và số mol của X chiếm 50% số mol của hỗn hợp E. Đốt cháy x gam hỗn hợp E cần dùng 1,1475 mol O2, sản phẩm cháy dẫn qua dung dịch KOH đặc dư thấy khối lượng bình tăng 60,93 gam; đồng thời có một khí duy nhất thoát ra. Mặt khác đun nóng x gam E với dung dịch NaOH vừa đủ, thu được dung dịch chỉ chứa 0,36 mol muối của A và 0,09 mol muối của B (A, B là hai α-aminoaxit no, trong phân tử chứa 1 nhóm –NH2 và 1 nhóm –COOH). Phần trăm khối lượng của Z có trong hỗn hợp E là A. 20,5% B. 24,6% C. 13,7% D. 16,4% Câu 35: Chất nào sau đây vừa tác dụng được với H2NCH2COOH, vừa tác dụng được với CH3NH2? A. NaOH. B. CH3OH. C. NaCl. D. HCl. Câu 36: Phát biểu không đúng là A. Sản phẩm thủy phân xenlulozơ (xúc tác H+, to) có thể tham gia phản ứng tráng gương. B. Dung dịch mantozơ tác dụng với Cu(OH)2 khi đun nóng cho kết tủa Cu2O. C. Thủy phân (xúc tác H+, t0) saccarozơ cũng như mantozơ đều cho cùng một monosaccarit. D. Dung dịch fructozơ hoà tan được Cu(OH)2. Câu 37: Hỗn hợp X gồm một axit cacboxylic no hai chức, mạch hở; hai ancol no đơn chức kế tiếp nhau trong dãy đồng đẳng và một đieste tạo bởi axit và cả 2 ancol đó. Đốt cháy hoàn toàn 4,84 gam X trên thu được 7,26 gam CO2 và 2,70 gam H2O. Mặt khác, đun nóng 4,84 gam X trên với 80 ml dung dịch NaOH 1M, sau phản ứng thêm vừa đủ 10 ml dung dịch HCl 1M để trung hòa lượng NaOH dư. Cô cạn phần dung dịch thu được m gam muối khan, đồng thời thu được 896 ml hỗn hợp ancol (đktc) có tỉ khối hơi so với H2 là 19,5. Giá trị của m gần nhất với A. 4,5 B. 5,7 C. 5,1 D. 4,9 Câu 38: Thủy phân m gam hỗn hợp X gồm este đơn chức M (C5H8O2) và este hai chức N (C6H10O4) cần vừa đủ 150 ml dung dịch NaOH 1M rồi cô cạn thu được hỗn hợp Y gồm hai muối và hỗn hợp Z gồm hai ancol no đơn chức, đồng đẳng kế tiếp, ngoài ra không chứa sản phẩm hữu cơ nào khác. Cho toàn bộ hỗn hợp Z tác dụng với một lượng CuO (dư) nung nóng thu được hỗn hợp hơi T (có tỉ khối hơi so với H2 là 13,75). Cho toàn bộ hỗn hợp T tác dụng với một lượng dư dung dịch AgNO3/NH3 thu được 32,4 gam Ag. Các phản ứng xảy ra hoàn toàn. Thành phần phần trăm của muối có phân tử khối nhỏ hơn trong Y là A. 38,84%. B. 48,61%. C. 42,19%. D. 41,23%. Câu 39: Tính chất đặc trưng của kim loại là tính khử (dễ bị oxi hoá thành ion dương) vì A. Nguyên tử kim loại có năng lượng ion hoá nhỏ. B. Nguyên tử kim loại thường có 5, 6, 7 electron lớp ngoài cùng. C. Nguyên tử kim loại có độ âm điện lớn. D. Kim loại có xu hướng thu thêm electron để đạt cấu hình của khí hiếm. Câu 40: Tơ nilon - 6 có công thức cấu tạo nào sau đây? A. (-NH[CH2]6NHCO[CH2]4CO-)n B. (-NH[CH2]6CO-)n C. (-CH2-CH(CN)-)n D. (-NH[CH2]5CO-)n LỜI GIẢI CHI TIẾT Câu 1: Đáp án A Xà phòng được sản xuất bằng cách đun nóng chất béo với dung dịch kiềm. Còn chất tẩy rửa tổng hợp được tổng hợp từ các chế phẩm của dầu mỏ → A sai Câu 2: Đáp án C Câu 3: Đáp án B (C4H6)k + H2 → C4kH6k +2 %H = . 100% = 11,765% → k = 5 Câu 4: Đáp án D Câu 5: Đáp án C Câu 6: Đáp án C Câu 7: Đáp án A Câu 8: Đáp án A Câu 9: Đáp án B Câu 10: Đáp án B Câu 11: Đáp án D Câu 12: Đáp án A Gọi số mol tripeptit là x mol → số mol NaOH phản ứng là 3x, số mol H2O là x mol Bảo toàn khối lượng → 4,34 + 40.3x = 6,38 + 18x → x= 0,02 mol Khi thủy phân X bằng dung dịch HCl dư → mmuối = mX + mHCl + mH2O → mmuối = 4,34 + 0,02.3. 36,5 + 0,02.2 . 18 = 7,25 gam Câu 35: Đáp án D Câu 36: Đáp án C Câu 37: Đáp án B HD: Phân tích nhanh các giả thiết có: 2 ancol có M = 19,5 × 2 = 39 → là CH3OH và C2H5OH.
Để tiện hơn, ta nên lấy công thức đại diện là C1,5H5O, số mol là 0,04 mol. Có 2 hướng giải quyết cho bài toán này: ♦ 1 (quen thuộc) là gọi số mol 3 chất ban đầu là x, y, z. lập hệ gồm: số mol ancol, số mol tác dụng NaOH và bảo toàn O → giải ra x, y, z. công việc sau đó không có gì khó khăn.
♦ 2. Có thể đi theo hướng suy luận sau: đốt X → CO2 + H2O. cộng thêm 2 vế với 2x mol H2O
(với x là số mol este) → vế trái sẽ gồm: 0,035 mol axit 2 chứ, no mạch hở và 0,04 mol ancol C1,5H5O.
vế phải gồm: 0,165 mol CO2 và (0,15 + 2x) mol H2O. chú ý: đốt cùng số mol axit 2 chức, no mạch hở với ancol no mạch hở sẽ cho nCO2 = nH2O → hiệu: nH2O – nCO2 = (0,15 + 2x) – 0,165 = đốt 0,05 mol ancol no hở = 0,05 → x = 0,01 mol. do đó phản ứng với NaOH, sau thêm HCl sẽ thu được 0,035 mol muối axit và 0,01 mol NaCl.
Bảo toàn khối lượng có maxit = 4,84 + 0,02 × 18 – 0,04 × 39 = 3,64 gam. Tác dụng NaOH thì 1 H đổi 1Na nên tiếp tục bảo toàn ta có: m = 3,64 + 0,07 × (23 – 1) + 0,01 × 58,5 = 5,765 gam. Câu 38: Đáp án B Nhận thấy khi oxi hóa ancol bằng CuO luôn thu được hợp chất hữu cơ C (andehit hoặc xeton) và nước có số mol bằng nhau Ta có MT = = 27,5 → MC = 37 → C chứa 2 anđehit kế tiếp nhau là HCHO, CH3CHO
Do MC = 37 , sử dụng đường chéo → HCHO và CH3CHO có số mol bằng nhau. Gọi số mol của HCHO và CH3CHO là x mol Khi tham gia phản ứng tráng bạc → nAg = 4x + 2x = 0,3 → x = 0,05 mol Vậy 2 ancol thu được gồm CH3OH : 0,05 mol và C2H5OH : 0,05 mol Khi thủy phân hỗn hợp X cần dùng 0,15 mol NaOH thu được 2 muối và 2 ancol CH3OH : 0,05 mol; C2H5OH : 0,05 mol → B có cấu tạo CH3OOC-CH2COOC2H5 : 0,05 mol và A phải có cấu tạo dạng este vòng C5H8O2
Luôn có nNaOH = 2nB + nA → nA = 0,05 mol Vậy hỗn hợp Y gồm NaOOOC-CH2-COONa: 0,05 mol và C5H9O3Na : 0,05 mol → % NaOOC-CH2-COONa= % = 48,61%. Câu 39: Đáp án A Câu 40: Đáp án D 1-A | | | | | | | 8-A | 9-B | 10-B | 11-D | | | | | | | 18-B | 19-B | | 21-D | | | | | | | 28-D | 29-C | | 31-C | 32-B | 33-D | 34-C | 35-D | 36-C | 37-B | 38-D | 39-A | 40-D |
ĐỀ CƯƠNG ÔN TẬP HỌC KÌ 2 - HÓA HỌC 10
A. BÀI TẬP TRẮC NGHIỆM HALOGEN Câu 1: Các nguyên tử nhóm VIIA có cấu hình e ở lớp ngoài cùng là 3s2 3p5 B. 2s2 2p5 C. 4s2 4p5 D. ns2 np5
Câu 2: Trong các hợp chất số oxi hóa của clo là: -1, 0+2, +3, +5 B. -1, 0, +1, +2, +7 C. -1, +1, +3, +7 D. -1, 0, +1, +2, +3, +4, +5
Câu 3: Trong các khí sau: F2, O3, N2, O2, Cl2, chất khí có màu vàng lục là F2 B. O3 C. N2 D. Cl2
Câu 4: Trong các chất sau: O2, N2, Cl2, CO2, chất thường diệt khuẩn và tẩy màu là O2 B. N2 C. Cl2 D. CO2
Câu 5: Trong các halogen sau: F2, Cl2, Br2, I2, halogen phản ứng mãnh liệt nhất là Cl2 B. Br2 C. F2 D. I2
Câu 6: Sục một lượng khí clo vừa đủ vào hỗn hợp NaI và NaBr nung nóng thì chất khí bay ra là Cl2, Br2 B. I2 C. Br2 D. I2 , Br2
Câu 7: Nước Gia-ven được điều chế bằng cách Cho clo tác dụng với nước B. Cho clo tác dụng với Ca(OH)2
C. Cho clo sục vào dd KOH nung nóng D. Cho clo sục vào dung dịch NaOH Câu 8: Trong các chất sau: Cl2, I2, NaOH, Br2, chất nào dùng để phòng chống bệnh bứu cổ Cl2 B. I2 C. NaOH D. Br2
Câu 9: Trong các chất: N2, Cl2, O2, H2chất duy trì sự cháy: N2 B. Cl2 C. O2 D. N2 vaø H2
Câu 10: muối bạc halogenua tan trong nước là AgCl B. AgI C. AgBr D. AgF
Câu 11: Tính oxi hóa của các halogen giảm dần theo chiều nào sau đây Cl2 > Br2 > I2 > F2 B. F2 > Cl2 > Br2 > I2
C. Br2 > F2 > I2 > Cl2 D. Cl2 > F2 > I2 > Br2 Caâu 12: Thuốc thử để nhận biết HCl và muối clorua là: A. Dung dịch AgNO3. B. Dung dịch Ba (OH)2. C. Dung dịch BaCl2. D. Dung dịch NaOH. Caâu 13: Tính axit tăng theo chiều sắp xếp: H2SO3 < H3PO4 < H2SO4 < HClO4 B. H3PO4 < H2SO3 < H2SO4 < HClO4
C. H3PO4 < H2SO4 < HClO4 < H2SO3 D. HClO4 < H2SO3 < H3PO4 < H2SO4 Caâu 14: Số oxi hóa của clo trong các hợp chất: HCl, KClO3, HClO, HClO2, HClO4 lần lượt là +1, +5, -1, +3, +7 B. -1, +5, +1, -3, -7 C. -1, -5, -1, -3, -7 D. -1, +5, +1, +3, +7
Caâu 15: thuốc thử dùng để nhận biết KF, KCl, KBr, KI là AgNO3 B. NaOH C. Quỳ tím D. Cu
Caâu 16. Hoà tan 12 gam hỗn hợp gồm Fe và Cu bằng dung dịch HCl dư, sau phản ứng thu được 2,24 lít khí (đktc) và m gam một chất rắn không tan. Giá trị của m là A. 5,6 gam. B. 6,5 gam. C. 6,4 gam. D. 4,6 gam. Caâu 17: Cho hoãn hôïp caùc khí N2, Cl2, SO2, CO2, H2 suïc töø töø qua dung dòch NaOH dö, ngöôøi ta thu ñöôïc hoãn hôïp khí thoát ra coù thaønh phaàn laø Cl2, N2, H2 B. Cl2, H2 C. N2, Cl2, CO2 D. N2, H2 Caâu 18: Trong daõy caùc axit cuûa clo: HCl, HClO, HClO2, HClO3, HClO4 soá oxi hoaù cuûa clo laàn löôït laø -1, +1, +2, +3, +4 B. -1, +1, +3, +5, +7 C. -1, +2, +3, +4, +5 D. -1, +1, +2, +3, +7
Caâu 19: Bieát raèng tính phi kim giaõm daàn theo thöù töï F, O, Cl, N. Trong caùc phaân töû sau, phaân töû naøo coù lieân keát phaân cöïc maïnh nhaát? F2O B. Cl2O C. NCl3 D. NF3
Caâu 20: Phaûn öùng naøo khoâng theå xaûy ra ñöôïc giöõa caùc caëp chaát sau KNO3 vaø Na2SO4 B. BaCl2 vaø Na2SO4 C. MgCl2 vaø NaOH D. Na vaø nöôùc
Caâu 21. Để trung hoà m gam HCl cần dùng 100ml dung dịch NaOH 1M. Giá trị của m là A. 36,5 gam. B. 3,65 gam. C. 7,3 gam. D. 73 gam. Caâu 22: Coù 3 dung dòch NaOH, HCl, H2SO4 loaõng. Thuoác thử ñeå phaân bieät dung dòch laø Zn B. Al C. BaCO3 D. AgNO3 vaø NaCl
Caâu 23: Phaûn öùng naøo khoâng xaûy ra ñöôïc giöõa caùc caëp chaát sau? KNO3 vaø NaCl B. Ba(NO3)2 vaø Na2SO4 C. AgNO3 vaø NaCl D. Cu(NO3)2 & NaOH
Caâu 24: Thuoác thöû ñaëc tröng ñeå nhaän bieát ra hôïp chaát halogenua trong dung dòch laø AgNO3 B. Ba(OH)2 C. NaOH D. Ba(NO3)2
Caâu 25: Axit HCl coù theå phaûn öùng ñöôïc vôùi nhöõng chaát naøo trong soá caùc chaát sau? Cu, CuO, Ba(OH)2, AgNO3, CO2 B. NO, AgNO3, CuO, quyø tím, Zn
C. Quyø tím, Ba(OH)2, CuO, CO D. AgNO3, CuO, Ba(OH)2, Zn, quyø tím Caâu 26: Noàng ñoä mol/l cuûa dung dòch hình thaønh khi ngöôøi ta troän laãn 200ml dung dòch HCl 2M vaø 300ml dung dòch HCl 4M laø: 3.0 B. 3.2 C. 5.0 D. 6.0
Caâu 27. Khi cho 15,8 gam kali permanganat (KMnO4) tác dụng với axit clohiđric đậm đặc thì thể tích khí clo (đktc) thu được là A. 5,0 lít. B. 5,6 lít. C. 11,2 lít. D. 8,4 lít. Caâu 28. Hoà tan hoàn toàn 12,8 gam hỗn hợp gồm Fe, FeO bằng dung dịch HCl 0,1M vừa đủ, thu được 2,24 lít khí (đktc). Thể tích dung dịch HCl đã dùng là A. 2,0 lít. B. 4,2 lít. C. 4,0 lít. D. 14,2 lít.
OXI - LƯU HUỲNH Caâu 1. Câu nào dưới đây diễn tả không đúng về tính chất hóa học của S và hợp chất của S? A. Lưu huỳnh vừa có tính oxi hóa, vừa có tính khử. B. Hiđrosunfua vừa có tính oxi hóa, vừa có tính khử. C. Lưu huỳnh đioxit vừa có tính oxi hóa, vừa có tính khử. D. H2SO4 đặc thể hiện tính oxi hóa mạnh Caâu 2. Nhóm chất nào sau đây chỉ có tính oxi hóa? A. H2O2, HCl, SO3 B. O2, Cl2, S C. O3, KClO4, H2SO4 đặc D. FeSO4, KMnO4, HBr Caâu 3. Có 3 dung dịch mất nhãn đựng các hóa chất: HCl, Na2SO3, H2SO4. Có thể phân biệt 3dung dịch bằng phương pháp hóa học với 1 hóa chất nào sau đây? A. Quỳ tím B. NaOH C. BaCl2 D. NaCl Caâu 4. Cho phản ứng hóa học sau: H2SO4đặc + 8HI → 4I2 + H2S + 4H2O Phát biểu nào sau đây không đúng tính chất của các chất? A. H2SO4 là chất oxi hóa, HI là chất khử. B. HI bị oxi hóa thành I2, H2SO4 bị khử thành H2S C. H2SO4 oxi hóa HI thành I2 và nó bị khử thành H2S D. HI oxi hóa H2SO4 thành H2S và nó bị khử thành I2. Caâu 5. Phát biểu nào sau đây không đúng với H2SO4? A. H2SO4 đặc, nóng có tính oxi hóa mạnh. B. H2SO4 đặc có tính háo nước C. H2SO4 có nhiều ứng dụng trong đời sống và sản xuất. D. H2SO4 là axit dễ bay hơi.
Caâu 6. SO2 phản ứng được với nhóm chất nào sau đây? A. P2O5, H2S, Cl2, NaOH C. H2S, NaOH, Cl2 KMnO4 B. Na2O, Cu(OH)2, Cl2, CO2 D. P2O5, CO2, Ba(OH)2, CaO Caâu 7. Trộn 30ml dd H2SO4 0,25 M với 40ml dd NaOH 0,2 M. Nồng độ của dd Na2SO4 trong dd thu được là A. 0,107M B. 0,057M C. 0,285M D. 0,357M Caâu 8. Cho chuỗi phản ứng sau: FeS2 A↑ A↑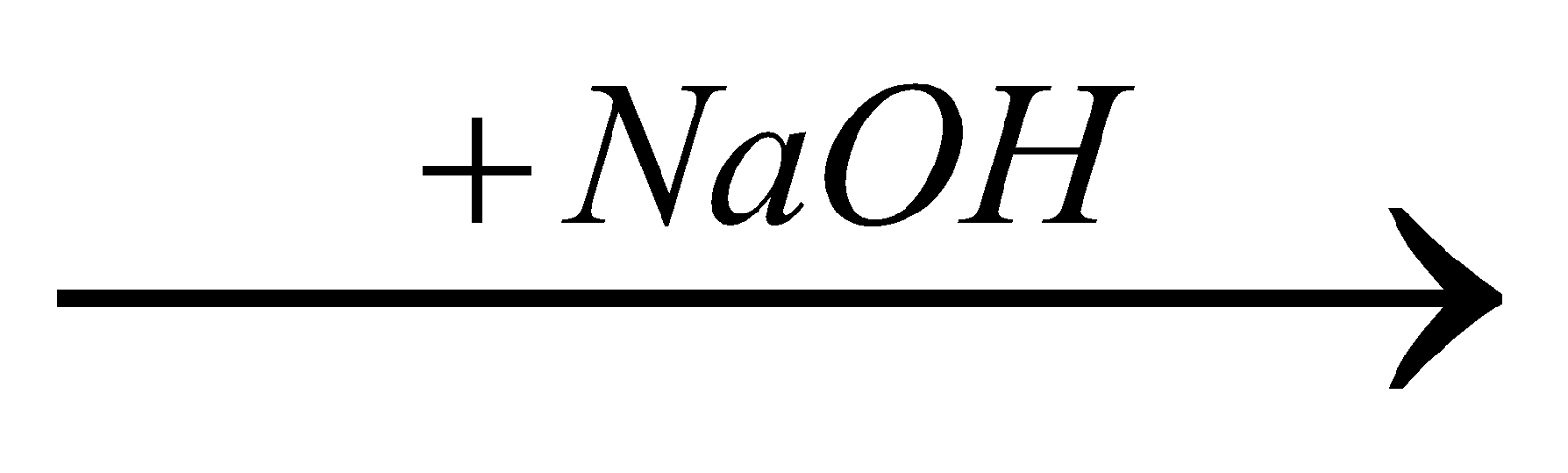 B B A A C C D D A, B, C, D lần lượt là: A. SO2, Na2SO3, H2S, FeS B. SO2, Na2SO3, S, FeS C. SO2, NaHSO3, SO3, FeSO4 D. S, Na2S, H2S, FeS Caâu 9. Trong các phản ứng sau, phản ứng nào không phải là phản ứng oxi hóa- khử? A. H2SO4 + S → SO2 + H2O B. H2SO4 + Fe →Fe2(SO4)3 + SO2 + H2O C. H2SO4 + Fe3O4 → FeSO4 + Fe2(SO4)3 + H2O D. H2SO4 + FeO → Fe2(SO4)3 + SO2 + H2O Caâu 10. Dãy chất nào sau đây tác dụng được với H2S? A. O2, Cl2, S, HCl B. O2, CuO, SO2, NaOH C. Cu(NO3)2, Pb(NO3)2, NaOH, O2 D. Pb(NO3)2, NaNO3, SO2, FeCl3 Caâu 11. Dãy chất nào sau đây đều tác dụng được với S? A. O2, Fe, H2, H2SO4 đặc B. O2, Zn, CuO, H2S C. H2O, HCl, Mg, H2SO4 D. Cu, Zn, H2, HCl Caâu 12. Cho 4,6 g S tác dụng với 4,6 g Na. Sau đó cho dd HCl dư vào sản phẩm thu được. Tính thể tích khí thoát ra (đktc). Cho các phản ứng xảy ra hoàn toàn. A. 22,4 lit B. 2,24 lit C. 1,12 lit D. 3,36 lit Caâu 13. Cho 2 đơn chất X, Y tác dụng với nhau, thu được khí A có mùi trứng thối. Đốt cháy A trong khí O2 dư thu được khí B có mùi hắc, A tác dụng với B tạo ra X. X, Y, A, B lần lượt là: A. S, H2, H2S, SO2 B. H2, S, H2S, SO2 C. H2, S, SO2, H2S D. S, H2, H2S, HSO4 Caâu 14. Trong phản ứng nào dưới đây, H2S thể hiện tính khử? A. 2H2S + 4Ag + O2 → 2Ag2S + 2H2O B. H2S + Pb(NO3)2 → PbS↓ + 2HNO3 C. 3H2S + 2KMnO4→ 2MnO2 + 3S + 2KOH + 2H2O D. 2H2S + 2Na → 2NaHS + H2 Caâu 5. Chọn câu trả lời đúng A. Độ âm điện của O nhỏ hơn của S B. Bán kính nguyên tử của O lớn hơn của S C. Tính phi kim của O mạnh hơn S D. Số electron lớp ngoài cùng của O ít hơn của S Caâu 16. Cấu hình electron của ion 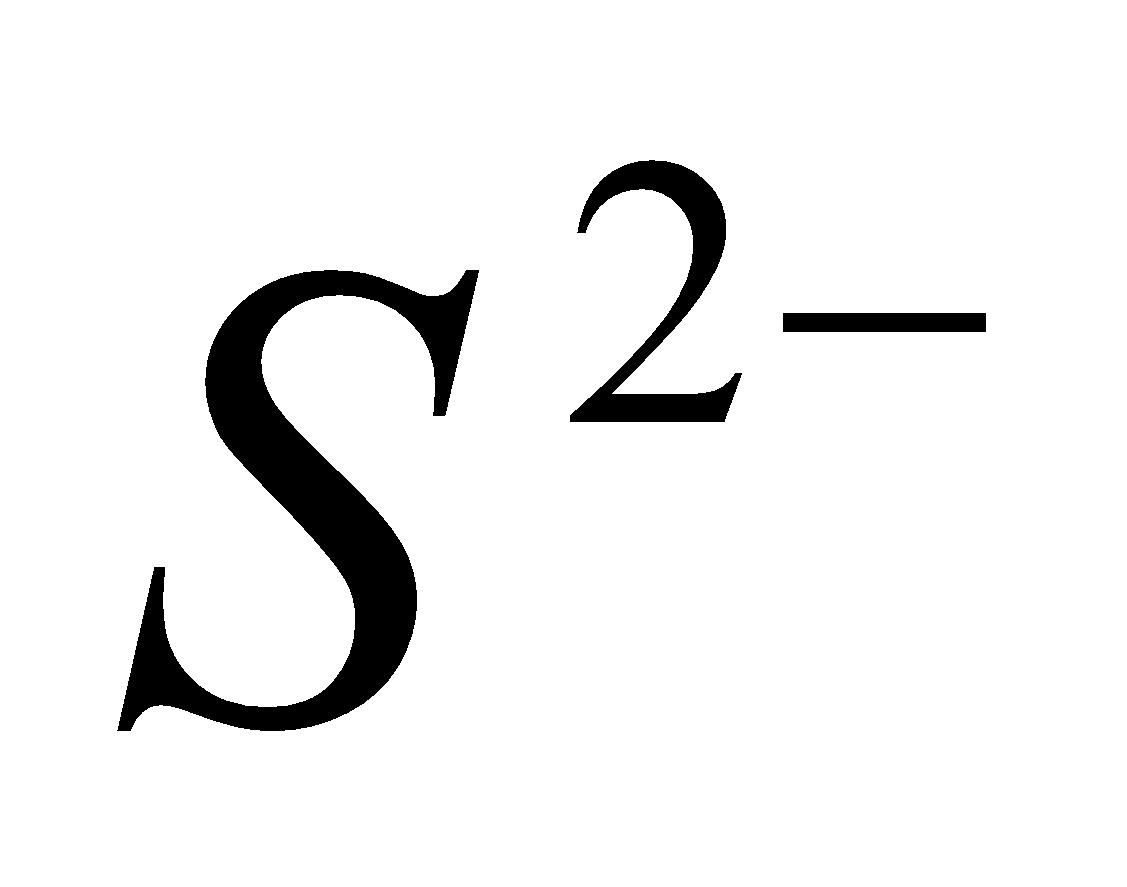 là là A. 1s22s22p63s23p4 B. 1s22s22p63s23p2 C. 1s22s22p63s23p6 D. 1s22s22p63s23p64s2 Caâu 17. Hấp thụ hoàn toàn 12,8 g SO2 vào 250ml dung dịch NaOH 1,0M. Khối lượng muối tạo thành sau phản ứng là A. 15,6g, 5,3g B. 18g, 6,3g C. 15,6g, 6,3g D. Kết quả khác Caâu 18. Trộn 2 thể tích H2SO4 0,2M với 3 thể tích H2SO4 0,5M được dung dịch H2SO4 có nồng độ là A. 0,38M B. 0,4M C. 0,25M D. 0,15M Caâu 19. Số mol H2SO4 cần dùng để pha chế 5,0 lit dung dịch H2SO4 2,0 M là A. 10 mol B. 5 mol C. 20 mol D. 2,5 mol Caâu 20. Cho 3,9g kim loại X hoá trị II vào 250 ml H2SO4 loãng 0,3M, để trung hoà lượng axit dư cần dùng 60ml dd KOH 0,5M. Kim loại X là A. Mg B. Zn C. Mn D. Al Caâu 21. Kim loại nào sau đây, bị thụ động trong H2SO4 đặc nguội? A. Zn, Al. B. Fe, Al. C. Cu, Fe. D. Zn, Fe. Caâu 22. Sản xuất SO3 bằng cách oxi hoá SO2 bằng oxi ở nhiệt độ A. 3500C đến 4000C. B. 4000C đến 4500C. C. 4500C đến 5000C. D. 5000C đến 5500C. Caâu 23. Chỉ dùng một thuốc thử nào dưới đây để phân biệt các lọ đựng riêng biệt khí SO2 và CO2? A. dung dịch brom. B. dung dịch NaOH. C. dung dịch Ba(OH)2. D. dung dịch Ca(OH)2. Caâu 24. Cho FeCO3 tác dụng với H2SO4 đặc nóng dư. Sản phẩm khí thu được là A. CO2 và SO2. B. H2S và CO2. C. SO2. D. CO2. Caâu 25. Cho một lượng dư khí H2S (đktc) vào dung dịch CuSO4 dư, thu được 1,92 gam kết tủa. Thể tích khí H2S cần dùng là A. 0,448 lít. B. 0,224 lít. C. 0,672 lít. D. 0,896 lít. Caâu 26. Hoà tan hoàn toàn 5,6 lít khí SO2 (đktc) vào 100ml dung dịch KOH 3,5M. Muối tạo thành sau phản ứng là A. K2SO3. B. KHSO3. C. K2SO3 và KHSO3. D. kết quả khác. Caâu 27. Cho V ml SO2 (đktc) sục vào dung dịch Br2 tới khi mất màu hoàn toàn dung dịch brom thì dừng lại, sau đó thêm dung dịch BaCl2 dư vào thì thu được 2,33 gam kết tủa. Giá trị của V là A. 112 ml. B. 224 ml. C. 1,12 ml. D. 4,48 ml. Caâu 28. Để phản ứng vừa đủ với 100ml dung dịch BaCl2 2M cần phải dùng 500ml dung dịch Na2SO4 với nồng độ bao nhiêu? A. 0,1M. B. 0,4M. C. 1,4M. D. 0,2M. Caâu 29. Để trung hoà 500 ml dung dịch X chứa hỗn hợp HCl 0,1M và H2SO4 0,3M cần bao nhiêu ml dung dịch NaOH 0,5M? A. 200ml. B. 300ml. C. 500ml. D. 700ml. Caâu 30. Hoà tan hoàn toàn 13 gam một kim loại M có hoá trị II vào dung dịch H2SO4 loãng thu được 4,48 lít khí H2 (đktc). Kim loại đó là A. Mg. B. Zn. C. Cu. D. Fe. Caâu 31. Hoà tan hoàn toàn 8,9 gam hỗn bột gồm hai kim loại Mg và Zn bằng dung dịch H2SO4 loãng dư, sau phản ứng thu được dung dịch X và 4,48 lít khí H2 (đktc). Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là A. 28,0 gam. B. 29,1 gam. C. 29,0 gam. D. 28,1 gam.
TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HÓA HỌC Câu 1: Trong các phản ứng sau đây, phản ứng nào áp suất không ảnh hưởng đến cân bằng phản ứng? A. N2 + 3H2 2NH3 B. N2 + O2 2NO. C. 2NO + O2 2NO2. D. 2SO2 + O2 2SO3 Câu 2: Sự chuyển dịch cân bằng là A. Phản ứng trực tiếp theo chiều thuận . B. Phản ứng trực tiếp theo chiều nghịch. C. Chuyển từ trạng thái cân bằng này thành trạng thái cân bằng khác. D. Phản ứng tiếp tục xảy ra cả chiều thuận và chiều nghịch. Câu 3: Cho phản ứng sau đây ở trạng thái cân bằng A(k) + B(k) C(k) + D(k)   Nếu tách khí D ra khỏi môi trường phản ứng, thì : A. Cân bằng hoá học chuyển dịch sang bên phải. B. Cân bằng hoá học chuyển dịch sang bên trái. C. Tốc độ phản ứng thuận và tốc độ của phản ứng nghịch tăng như nhau. D. Không gây ra sự chuyển dịch cân bằng hoá học. Câu 4: Cho phản ứng ở trạng thái cân bằng : H2 (k) + Cl2 (k) 2HCl(k) + nhiệt ( H<0) H<0) Cân bằng sẽ chuyể dịch về bên trái, khi tăng: A. Nhiệt độ. B. Áp suất. C. Nồng độ khí H2. D. Nồng độ khí Cl2 Câu 5: Cho phản ứng ở trạng thái cân bằng : A(k) + B(k) C(k) + D(k)  Ở nhiệt độ và áp suất không đổi, xảy ra sự tăng nồng độ của khí A là do: A. Sự tăng nồng độ của khí B. B. Sự giảm nồng độ của khí B. C. Sự giảm nồng độ của khí C. D. Sự giảm nồng độ của khí D. Câu 6: Cho phản ứng ở trạng thái cân bằng : H2(k) + Cl2(k) 2HCl(k) + nhiệt  Cân bằng sẽ chuyển dịch về bên phải, khi tăng : A. Nhiệt độ. B. Áp suất. C. Nồng độ khí H2 D. Nồng độ khí HCl Câu 7: Ở nhiệt độ không đổi, hệ cân bằng nào sẽ dịch chuyển về bên phải nếu tăng áp suất : A. 2H2(k) + O2(k) 2H2O(k) B. 2SO3(k) 2SO2(k) + O2(k) C. 2NO(k) N2(k) + O2(k) D. 2CO2(k) 2CO(k) + O2(k) Câu 8: Đối với một hệ ở trạng thái cân bằng, nếu thêm chất xúc tác thì A. Chỉ làm tăng tốc độ của phản ứng thuận. B. Chỉ làm tăng tốc độ của phản ứng nghịch. C. Làm tăng tốc độ của phản ứng thuận và phản ưng nghịch như nhau. D. Không làm tăng tốc độ phản ứng thuận và phản ứng nghịch. Câu 9: Khi ninh (hầm) thịt cá, người ta làm gì cho chúng nhanh chín ? A. Dùng nồi áp suất B. Chặt nhỏ thịt cá. C. cho thêm muối vào. D. Cả 3 đều đúng. Câu 10: Tốc độ phản ứng là A. Độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian. B. Độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian. C. Độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian. D. Độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian. Câu 11: Cho 5g kẽm viên vào cốc đựng 50ml dung dịch H2SO4 4M ở nhiệt độ thường (25o). Trường hợp nào tốc độ phản ứng không đổi ? A. Thay 5g kẽm viên bằng 5g kẽm bột. B. Thay dung dịch H2SO4 4M bằng dung dịch H2SO4 2M. C. Thực hiện phản ứng ở 50oC. D. Dùng dung dịch H2SO4 gấp đôi ban đầu.
B. BÀI TẬP TỰ LUẬN Câu 1. Dung dịch HCl phản ứng được với chất nào sau đây: NaOH, Al, CuSO4, CuO, Fe3O4, AgNO3, CaCO3, Cu(OH)2, Cu, Fe, MgCO3, CaO, Al2O3, Na2SO4, H2SO4. Viết phương trình hóa học xảy ra? Câu 2. Clo tác dụng được với chất nào sau đây: Na2SO4, CaCO3, KI, NaOH, FeCl2, MgCl2, Cu, CaO, Fe, MgCO3, H2O, Al2O3. Viết phương trình hóa học xảy ra? Câu 3. Hoàn thành chuổi phản ứng sau (ghi rõ đầy đủ điều kiện xúc tác) a) 
b) MnO2 🡪 Cl2 🡪 HCl 🡪 FeCl2 🡪 FeCl3 🡪 Fe(OH)3 🡪 Fe2O3 c) NaCl 🡪 NaOH 🡪 NaBr 🡪 NaCl 🡪 HCl 🡪 FeCl2 d) KMnO4🡪 Cl2 🡪 Clorua vôi 🡪 Cl2 🡪 NaCl 🡪 NaOH 🡪 NaCl e) Cl2 ↔ NaCl ↔ NaOH 
HCl AgNO3 g) Cl2 🡪 FeCl3 🡪 NaCl 🡪 X↓ Br2 🡪 I2 h) Br2  HBr HBr  NaBr NaBr  NaCl NaCl  Cl2 Cl2 Câu 4. Trình bày phương pháp hóa học nhận biết các dung dịch đựng trong các lọ mất nhãn sau: HCl; HNO3; KCl; KNO3. Câu 5. Hòa tan hoàn toàn 60,0 gam hỗn hợp X gồm Mg và Fe vào dung dịch axit clohiđric 0,5 M thu được dung dịch A và 33,6 lít khí thoát ra (đktc). Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp X. Tính khối lượng muối thu được. Tính thể tích dung dịch axit clohiđric đã dùng, biết lượng axit đã dùng dư 5 %.
Câu 6. Hòa tan hoàn toàn 42,2 gam hỗn hợp Zn và ZnO cần dùng vừa đủ 100,8 ml dung dịch HCl 36,5% (D = 1,19g/ml) thu được V lít khí (đktc) và dung dịch A. a/ Tính thành phần % về khối lượng các chất trong hỗn hợp ban đầu. b/ Tính V. c/ Tính nồng độ phần trăm của dung dịch A. Câu 7. Cho 31,5 g hỗn hợp gồm Mg, Zn tác dụng hết với 300g dung dịch H2SO4 loãng thu được 17920ml khí (đktc). Tính khối lượng mỗi kim loại. Tính nồng độ % H2SO4. Tính nồng độ mol H2SO4 (D= 0,5g/ml).
Câu 8. Cho 25,95g hỗn hợp gồm Zn, ZnO tác dụng hết với 250g dung dịch H2SO4 loãng thu được 7840 ml khí (đktc). Tính % mỗi chất trong hỗn hợp. Tính nồng độ % H2SO4. Tính nồng độ % muối.
Câu 9. Cho 6,8 g hỗn hợp X gồm Mg và Fe vào dd H2SO4 loãng thì thu được 3,36 lit khí bay ra (đktc). a. Tính % khối lượng mỗi kim loại trong X? b. Nếu cho hỗn hợp trên tác dụng với H2SO4 đ, nóng. Hãy tính VSO2 (đktc)? c. Tính % khối lượng mỗi kim loại trong hh X Câu 10. Nung nóng 4,37g hỗn hợp bột các kim loại Fe và Zn với bột S dư. Chất rắn thu được đem hòa tan bằng dung dịch axit H2SO4 loãng, nhận thấy có 1,568 lít khí (đktc) thoát ra. Tính khối lượng mỗi kim loại trong hỗn hợp đầu. Tính thành phần % về khối lượng mỗi muối sunfat khan thu được
ĐỀ THI THỬ ĐỀ 1 Câu:1 Sau khi chuyển 1 thể tích khí oxi thành ozon thì thấy thể tích giảm đi 5ml (biết các thể tích đo ở cùng điều kiện) Thể tích oxi đã tham gia pứ là : A/ 14ml B/ 16ml C/ 17ml D/ 15ml Câu:2 Cho pứ: H2SO4+ Fe→Fe2(SO4)3+H2O+SO2. Tỉ lệ số ptử H2SO4 đóng vai trò oxi hoá và môi trường là: A/ 6:1 B/ 1:6 C/ 1:1 D/ 1:3 Câu:3 Cho một luồng khí Clo dư tác dụng với 9,3 g kim loại thu được 23,62 g muối kim loại .Muối kim loại thu được là: A/ NaCl B/ LiCl C/ KCl D/ AgCl Câu:4 Có những pứ hoá học: Cl2+2NaBr→2NaCl+Br2 (1) Br2+2NaI→2NaBr+I2 (2). Từ 2 pứ này rút ra nhận xét A/ Clo có tính oxi hoá mạnh hơn brom B/ Brom có tính oxi hoá mạnh hơn iot C/ Iot có tính oxi hoá mạnh hơn brom,brom có tính oxi hoá mạnh hơn clo D/ Clo oxi hoá được ion Br-,brom oxi hoá được ion I- . Hãy cho biết nhận xét nào không đúng. Câu:5 Khối lượng dd axit H2SO4 98% và khối lượng H2O cần dùng để pha chế 300g dd H2SO4 36% tương ứng là: A/ 98g và 202g B/ 60g và 240g C/ 110,2g và 189,8g D/ 92,5g và 207,5g Câu:6 Phản ứng sản suất nước javen: Cl2+NaOH→NaCl+NaClO+H2O. Clo đóng vai trò là: A/ Chất oxi hoá B/ Chất khử C/ Vừa là chất oxi hoá ,vừa là chất khử D/ Không là chất oxi hoá,không là chất khử Câu:7 Ở 8500C,hằng số cân bằng của pứ: CO2+H2 CO+H2O(k) bằng 1.Nồng độ ban đầu các chất như sau: [CO2]=0,2mol/l [H2]=0,8mol/l .Nồng độ khí CO ở trạng thái cân bằng là: CO+H2O(k) bằng 1.Nồng độ ban đầu các chất như sau: [CO2]=0,2mol/l [H2]=0,8mol/l .Nồng độ khí CO ở trạng thái cân bằng là: A/ 0,24mol/l B/ 0,32mol/l C/ 0,64mol/l D/ 0,16mol/l Câu:8 Thí nghiệm cho biết: HBr+H2SO4 đặc→Br2+SO2↑+H2O; HCl+H2SO4 đặc không xảy ra phản ứng.Từ thí nghiệm rút ra nhận xét A/ HBr khử được H2SO4 đặc B/ HBr có tính khử mạnh hơn HCl C/ HCl có tính khử mạnh hơn HBr nên H2SO4 không oxi hoá được D/ H2SO4 đặc oxi hoá được HBr,nhưng không oxi hoá được HCl. Hãy cho biết nhận xét nào sai. Câu:9 Trộn dung dịch chứa 1 mol axit H2SO4 với dd chứa 1,5mol NaOH. Sau khi pứ xảy ra hoàn toàn,cho dung dịch bay hơi đến khô.Chất rắn thu được là: A/ Muối NaHSO4 B/ Hỗn hợp muối NaHSO4,Na2SO4 C/ Muối Na2SO4 D/ Hỗn hợp NaHSO4,Na2SO4,NaOH Câu:10 Cho phản ứng thuận nghịch ở trạng thái cân bằng: H2(k)+Cl2(k) 2HCl(k) ; ΔH<0. Cân bằng sẽ chuyển dịch theo chiều nghịch,khi tăng: 2HCl(k) ; ΔH<0. Cân bằng sẽ chuyển dịch theo chiều nghịch,khi tăng: A/ Nhiệt độ B/ Áp suất C/ Nồng độ H2 D/ Nồng độ Cl2 Câu:11 Cho 2mol khí NO tác dụng với 1 lượng O2 trong bình dung tích với 1 lít , ở 400C, xảy ra phản ứng : 2NO+O2 2NO2. Khi pứ đạt tới trạng thái cân bằng,nồng độ các chất là:[O2]=0,0156mol/l ;[NO2] =0,500mol/l. Hằng số cân bằng K của pứ ở nhiệt độ đó bằng: 2NO2. Khi pứ đạt tới trạng thái cân bằng,nồng độ các chất là:[O2]=0,0156mol/l ;[NO2] =0,500mol/l. Hằng số cân bằng K của pứ ở nhiệt độ đó bằng: A/ 7,12 B/ 4,42 C/ 14,1 D/ 21,4 Câu:12 Axit sunfuric đặc pứ được với: 1/ Đồng 2/ Kim loại vàng 3/ Bazơ 4/ Cacbon 5/ Oxit lưỡng tính 6/ Bạc 7/ Hidro clorua 8/ Đường glucozơ 9/ Đồng sunfat .Những ý đúng là: A/ 1,3,5,6,8 B/ 2,4,6,8 C/ 1,2,4,5,7 D/ 3,5,6,8,9 Câu:13 Cho pứ thuận nghịch ở trạng thái cân bằng: 2SO2(k)+O2(k) 2SO3(k) ; ΔH<0. Cân bằng sẽ chuyển dịch theo chiều thuận, nếu: 2SO3(k) ; ΔH<0. Cân bằng sẽ chuyển dịch theo chiều thuận, nếu: A/ Giảm nồng độ của SO2 B/ Tăng nồng độ của SO2 C/ Tăng nhiệt độ D/ Giảm áp suất của hệ Câu:14 Khi cho khí clo vào dung dịch chứa KOH đậm đặc có dư và đun nóng thì dung dịch thu được gồm: A/ KCl,KOH dư B/ KCl,KClO3,KOHdư C/ KCl,KClO,KOHdư D/ KClO3, KOH dư Câu:15 Điều chế khí clo trong phòng thí nghiệm bằng phương pháp là: A/ Đun nhẹ HCl đậm đặc với MnO2 B/ Đun nhẹ HCl với MnSO4 C/ Cho NaCl tác dụng với dung dịch H2SO4 D/ Đun HCl với K2MnO4 Câu:16 Cho axit H2SO4 đậm đặc tác dụng với 58,5g NaCl đun nóng .Khí sinh ra cho hoà tan vào 146g nước .Nồng độ % dung dịch thu được là:(Các phản ứng xảy ra hoàn toàn) A/ 25% B/ 5,2% C/ 20% D/ 15% Câu:17 Sục khí H2S vào dung dịch nào sẽ không tạo thành kết tủa : A/ Ca(OH)2 B/ CuSO4 C/ AgNO3 D/ Pb(NO3)2 Câu:18 Một hỗn hợp gồm 4,80 gam magie và 5,60 gam sắt tác dụng với dung dịch axit sunfuric loãng, dư. Thể tích khí hiđro ( đktc ) được giải phóng sau phản ứng là bao nhiêu lít? A/ 4,48 lít B/ 2,24 lít C/ 6,72 lít D/ 7,84 lít Câu:19 Cần lấy bao nhiêu gam FeS2 để điều chế 1 lít dung dịch H2SO4 1M (giả sử hiệu suất phản ứng là 100%) - A/ 120 gam B/ 60 gam C/ 240 gam D/ 88 gam Câu:20 Hidrô peôxit có thể tham gia những phản ứng hoá học : H2O2 + 2KI → I2 + 2KOH (1) H2O2 + Ag2O → 2Ag + H2O + O2 (2) Tính chất của H2O2 được diễn tả đúng nhất là: A/ Có tính oxi hoá B/ Vừa có tính oxi hoá ,vừa có tính khử. C/ Không có tính oxi hoá và không có tính khử D/ Có tính khử Câu:21 Trong phản ứng : SO2 + H2S 🡪 3S + 3H2O . Câu nào diễn tả đúng : A/ Lưu huỳnh bị oxi hoá và hidro bị khử B/ Lưu huỳnh bị khử và hidro bị oxi hoá C/ Lưu huỳnh bị khử và không có sự oxi hoá D/ Lưu huỳnh trong SO2 bị khử, trong H2S bị oxi hoá Câu:22 Đốt cháy hoàn toàn 8,8g FeS và 12g FeS2 , khí thu được cho vào Vml dung dịch NaOH 25% (d=1,28g/ml) được muối trung tính. Tính V? A/ 96ml B/ 75ml C/ 122,88ml D/ 125ml Câu:23 Trong các phản ứng sau, phản ứng nào chất tham gia là axit sunfuric đặc : A/ H2SO4 + Cu → CuSO4 + H2O + SO2↑ B/ H2SO4 + Zn → ZnSO4 + H2↑ C/ H2SO4 + Fe(OH)2 → FeSO4 + H2O D/ H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O Câu:24 Phản ứng nào sau đây được dùng để điều chế khí clo trong công nghiệp ? A/ 2NaCl 2Na + Cl2 2Na + Cl2 B/ 2NaCl + 2H2O--(đf có mn)→ H2+2NaOH + Cl2 C/ MnO2 + 4HCl(đ) MnCl2+ Cl2 +2H2O MnCl2+ Cl2 +2H2O D/ F2+2NaCl→ NaF + Cl2 Câu:25 Có dung dịch muối NaCl bị lẫn tạp chất NaBr và NaI. Có thể dùng chất nào trong các chất dưới đâyđể làm sạch dung dịch muối NaCl ? A/ Khí clo B/ Khí oxi C/ Khí HCl D/ Khí flo Câu:26 Cho 12g kim loại M hoá trị 2 tác dụng hết với dung dịch H2SO4 loãng thu được 11,2 lit khí(00C,1atm). Kim loại M là: A/ Ca B/ Fe C/ Zn D/ Mg Câu:27 Lưu huỳnh dioxit tác dụng với khí oxi và có mặt của chất xúc tác , tạo ra lưu huỳnh trioxit: 2SO2 (k) + O2(k) 2SO3(k) . Cho hỗn hợp gồm 1 mol O2 và 2 mol SO2 vào một bình kín ,ở một nhiệt độ nhất định thì phản ứng đạt đến trạng thái cân bằng. Lúc này trong hỗn hợp có 1,75 mol SO2. Số mol khí O2 còn lại ở trạng thái cân bằng là bao nhiêu? 2SO3(k) . Cho hỗn hợp gồm 1 mol O2 và 2 mol SO2 vào một bình kín ,ở một nhiệt độ nhất định thì phản ứng đạt đến trạng thái cân bằng. Lúc này trong hỗn hợp có 1,75 mol SO2. Số mol khí O2 còn lại ở trạng thái cân bằng là bao nhiêu? A/ 0 mol B/ 0,125 mol C/ 0,250 mol D/ 0,875 mol Câu:28 Ở nhiệt độ thích hợp , hỗn hợp khí N2 và H2 đạt đến trạng thái cân bằng : N2(k)+3H2(k)  2NH3(k) 2NH3(k) Hỗn hợp khí thu được có thành phần : 1,5 molNH3 ; 2,0 molN2 và 3,0 molH2 . Có bao nhiêu mol H2 có mặt khi phản ứng ban đầu? A/ 4 mol B/ 3 mol C/ 4,5 mol D/ 5,25 mol Câu:29 Biện pháp nào sau đây không làm tăng lượng khí CO ở trạng thái cân bằng? CO2(k)+H2(k) CO (k)+ H2O(k) ; ΔH >0 CO (k)+ H2O(k) ; ΔH >0 A/ Giảm nồng độ của hơi nước B/ Tăng nồng độ của khí H2 C/ Tăng thể tích của bình chứa. D/ Tăng nhiệt độ của bình chứa. Câu:30 Cho phản ứng: H2SO4 (đ) + 8HI → 4I2 +H2S + H2O . Câu nào diễn tả không đúng tính chất các chất? A/ H2SO4 là chất oxi hoá , HI là chất khử B/ HI bị oxi hoá thành I2 , H2SO4 bị khử thành H2S C/ H2SO4 oxi hoá HI thành I2 và nó bị khử thành H2S D/ I2 oxi hoá H2S thành H2SO4 và nó bị khử thành HI -------------------------------------------------------------------------------- ĐỀ 2 A-TRẮC NGHIỆM 1. Hãy chỉ ra câu không chính xác: A. Trong tất cả các hợp chất, flo chỉ có số oxi hoá là -1 B. Từ flo đến iot, nhiệt độ nóng chảy của chúng giảm dần C. Bán kính nguyên tử tăng dần từ flo đến iot. D. Tất cả các hợp chất của halogen với hiđro điều là những chất khí ở t0 thường. 2. Để điều chế HBr người ta dùng phản ứng nào? A. HCl + NaBr  NaCl + HBr B. Br2 + H2O NaCl + HBr B. Br2 + H2O  HBr + HBrO HBr + HBrO C. PBr3 + 3H2O  H3PO3 + 3HBr D. H2 + Br2 H3PO3 + 3HBr D. H2 + Br2  2HBr 2HBr 3. Sục khí clo vào dung dịch KOH dư, ở t0 70 - 750C thu được dung dịch chứa các chất sau: A. KCl, KClO3, KOH, H2O B. KCl, KClO, Cl2, H2O C. KCl, KClO, H2O D. KClO3, KClO, KOH, H2O 4. Axit HCl thể hiện tính oxi hoá trong phản ứng nào: A. 2KMnO4 + 16HCl  2MnCl2 + 2KCl + 5Cl2 + 8H2O B. 2HCl + Fe 2MnCl2 + 2KCl + 5Cl2 + 8H2O B. 2HCl + Fe  FeCl2 + H2 FeCl2 + H2 C. 2HCl + Fe(OH)2  FeCl2 + 2H2O D. 6HCl + Al2O3 FeCl2 + 2H2O D. 6HCl + Al2O3  2AlCl3 + 3H2O 2AlCl3 + 3H2O 5. Trong các phản ứng sau đây phản ứng dùng điều chế oxi trong công nghiệp là: A. 2KMnO4  K2MnO4 + MnO2 + O2 K2MnO4 + MnO2 + O2 B. 2H2O B. 2H2O 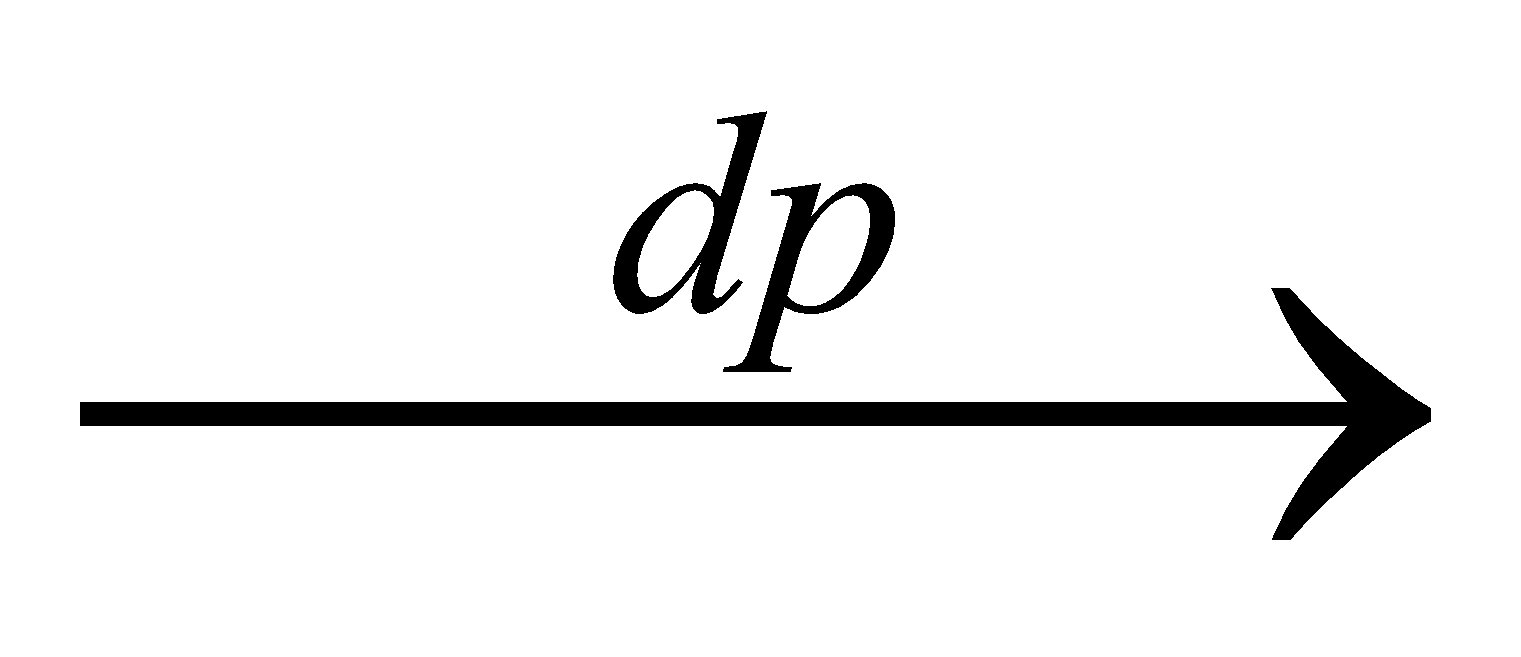 2H2 + O2 2H2 + O2 C. 2Ag + O3  Ag2O + O2 Ag2O + O2  D. 2KNO3 D. 2KNO3  2KNO2 + O2 2KNO2 + O2 6. Cho các khí gồm: Cl2, O2, CO, CH4, CO2 đi chậm qua bình đựng dd Ca(OH)2 dư. Hỗn hợp khí được giữ lại trong bình là: A. O2, CO, CH4 B. Cl2, CO2 C. Cl2, O2, CH4 D. O2, CO2 7. Cho dung dịch H2SO4 cho tới dư vào BaCO3, thấy hiện tượng: A. sủi bọt khí không màu B. Có kết tủa trắng C. Có  trắng và có khí ko màu D. có khí mùi hắc thoát ra. trắng và có khí ko màu D. có khí mùi hắc thoát ra. 8. Để điều chế SO2 người ta không dùng phản ứng nào: A. Na2SO3 + H2SO4  Na2SO4 + SO2 Na2SO4 + SO2 + H2O B. 4FeS2 + 11O2 + H2O B. 4FeS2 + 11O2  2Fe2O3 + 8SO2 2Fe2O3 + 8SO2 C. S + O2  SO2 SO2 D. Na2SO3 D. Na2SO3  Na2O + SO2 Na2O + SO2 9. Thuốc thử để phân biệt CO2 và SO2 là: A. dd nước brom B. dd Bari hidroxit C. dd nước vôi trong D. dd natri hiđrosunfit 10. Dung dịch dưới đây không phản ứng với dung dich AgNO3 là. A. NaF B. NaCl C. HCl D. CaCl2 11. Phản ứng chứng tỏ H2S là chất khử: A. H2S + 2NaOH  Na2S + 2H2O B. 2H2S + CuSO4 Na2S + 2H2O B. 2H2S + CuSO4  3S + 2H2O 3S + 2H2O C. H2S + CuSO4  CuS + H2SO4 D. H2S + NaOH CuS + H2SO4 D. H2S + NaOH  NaHS + H2O NaHS + H2O 12. Cho sơ đồ phản ứng: Mg + H2S04 (đặc)  MgSO4 + H2S MgSO4 + H2S + H2O + H2O Hệ số phân tử H2SO4 tham gia là chất oxi hoá là A. 1. B. 4. C. 5. D. 6. 13. Phát biểu nào sao đây không chính xác? A. Tính axit của HX tăng dần theo thứ tự sau: HI, HBr, HCl, HF, đo độ phân cực của liên kết giữa các halogen với hiđro tăng dần từ I đến F. B. Từ F2 đến I2 nhiệt độ nóng chảy tăng đần. C. Trong các halogen F2 có tính phi kim mạnh nhất. D. Nguyên tử halogen có 7e lớp ngoài cùng dễ dàng thu thêm 1e để tạo thành ion âm X- cấu hình e của khí hiếm liền kề trong bảng tuần hoàn. 14. Sục khí ozon vào dung dịch KI dư, ở nhiệt độ thường thu được dung dịch chứa các chất A. KOH, KI, I2, O2. B. KOH, I2. C. KOH, KI, I2. D. KOH, I2, O2 15. Phân biệt O2 và O3 bằng. A. tàn đóm đỏ B. giấy tẩm dung dịch KI và hồ tinh bột. C. kim loại Ag D. màu. 16. Xét phản ứng : 2SO2(k) + O2(k)  2SO3 ( 2SO3 ( H < 0) Để thu được nhiều SO3 ta cần: H < 0) Để thu được nhiều SO3 ta cần: A. Tăng nhiệt độ. B. Tăng áp suất. B. thêm xúc tác. D. giảm nhiệt độ. 17. Phát biểu nào sau đây đúng? A. Nói chung, các phản ứng hoá học khác nhau xảy ra nhanh chậm với tốc độ khác nhau không đáng kể. B. Tốc độ phản ứng là độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian. C. Tốc độ phản ứng là độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian. D. Tốc độ phản ứng được xác định theo lý thuyết. 18. Khẳng định nào sau đây không đúng? A. Nhiệt độ của ngọn lửa axetilen cháy trong oxi cao hơn nhiều so với cháy trong không khí. B. Nấu thực phẩm trong nồi áp suất nhanh chín hơn so với khi nấu chúng ở áp suất thường. C. Các chất đốt rắn (như than, củi) có kích thước nhỏ hơn sẽ cháy nhanh hơn. D. Nấu thực phẩm trên núi cao (áp suất thấp) thực phẩm nhanh chín hơn. 19. Cân bằng hoá học là cân bằng động vì: A. ở trạng thái cân bằng phản ứng không dừng lại, mà phản ứng thuận và phản ứng nghịch vẫn xảy ra, nhưng tốc độ bằng nhau. B. ở trạng thái cân bằng phản ứng nghịch vẫn xảy ra. C. ở trạng thái cân bằng phản ứng thuận vẫn xảy ra. D. ở trạng thái cân bằng phản ứng vẫn xảy ra. 20. Clo vừa là chất oxi hoá vừa là chất khử trong phản ứng của clo với: A. hidro B. sắt C. dd NaBr D. dd NaOH 21. Để làm khô khí clo người ta dùng: A. dd H2SO4 đặc B. vôi sống C. NaOH khan D. đá vôi khan 22. Sục khí O3 vào dd KI có nhỏ sẵn vài giọt hồ tinh bột, hiện tượng quan sát được là: A. dd có màu vàng nhạt B. dd có màu xanh C. dd trong suốt D. dd có màu tím 23. Trong các những chất sau đây, tính chất nào không là tính chất của axit sunfuric đặc nguội: A. háo nước B. Phản ứng hoà tan Al và Fe C. tan trong nước, toả nhiệt D. làm hoá than vải, giấy, đường 24. Cho cân bằng: 2NO2  N2O4 N2O4  Nhúng bình đựng NO2 và N2O4 thì: Nhúng bình đựng NO2 và N2O4 thì: A. hỗn hợp vẫn giữ nguyên màu như ban đầu. B. màu nâu đậm dần C. màu nâu nhạt dần D. hỗn hợp có màu khác 25. Hiđro sunfua là chất: A. có tính khử mạnh B. có tính oxi hoá mạnh C. có tính axit mạnh D. tan nhiều trong nước 26. Thuốc thử để phân biệt các ion F-, Cl-, Br-, I- là: A. quỳ tím B. dd hồ tinh bột C. dd Ba(NO3)2 D. dd AgNO3 27. Khí oxi được sử dụng nhiều trong lĩnh vực: A. y tế B. luyện thép C. công nghiệp hoá chất D. hàn cắt kim loại
TỔ HÓA 11 ĐỀ CƯƠNG ÔN TẬP MÔN HÓA HỌC LỚP 11 HỌC KÌ II
CHƯƠNG 5: HIĐROCACBON NO
A. KIẾN THỨC CẦN NẮM VỮNG
Định nghĩa ankan, công thức chung, đồng đẳng, đồng phân, danh pháp, tcvl, tchh, điều chế, ứng dụng. B. MỘT SỐ CÂU HỎI VÀ BÀI TẬP THAM KHẢO 1. Viết công thức cấu tạo các đồng phân ankan ứng với công thức phân tử C4H10, C5H12 và C6H14. Gọi tên theo danh pháp thường và tên thay thế. 2. Viết CTCT của các ankan có tên sau: a. pentan, 2-metylbutan, isobutan và 2,2-đimetylbutan. ; b. iso-pentan, neo-pentan, 3-etylpentan, 2,3-đimetylpentan. 3. Gọi tên các chất sau theo danh pháp thường và danh pháp thay thế: a. CH3-CH(CH3)-CH3 b. CH3-(CH2)4-CH3 c. CH3-CH(CH3)-CH2-CH3 d. CH3-C(CH3)2-CH3 4. Hoàn thành các PTHH của các phản ứng sau: a. C2H6 + Cl2 (1:1)  c. CH3-CH2-CH3 + Br2 (1:1) c. CH3-CH2-CH3 + Br2 (1:1) b. CH4 + O2  d. CH3COONa + NaOH d. CH3COONa + NaOH  5. Khi clo hóa C5H12 với tỷ lệ mol 1:1 thu được một sản phẩm thế monoclo duy nhất. a. Xác định CTCT và danh pháp thay thế của ankan đó. b. Viết PTHH của phản ứng xảy ra. 6. Đốt cháy hoàn toàn 2,24 lít ankan X (đktc) thu được 6,72 lít khí CO2 (đktc) và m gam nước. a. Xác định công thức của X. b. Tính khối lượng nước thu được 7. Đốt cháy hoàn toàn 2,24 lít ankan B (đktc) cần 11,2 lít O2 (đktc). a. Xác định công thức của B. b. Tính khối lượng CO2 và nước sinh ra. 8. Đốt cháy hoàn toàn 3,36 lít hỗn hợp khí metan và etan thu được 4,48 lít khí CO2 (đktc). Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A. CHƯƠNG 6 : HIDROCACBON KHÔNG NO A. KIẾN THỨC CẦN NẮM VỮNG ANKEN: Định nghĩa, công thức chung ,đồng đẳng, đồng phân, danh pháp, tchh, điều chế, ứng dụng. ANKAĐIEN: Định nghĩa , công thức chung, đồng đẳng, đồng phân, danh pháp, tchh, điều chế, ứng dụng ANKIN: Định nghĩa , công thức chung, đồng đẳng, đồng phân, danh pháp, tchh, điều chế, ứng dụng B. MỘT SỐ CÂU HỎI VÀ BÀI TẬP VẬN DỤNG 1. Viết CTCT các chất sau: a. buta-1,3-dien ; b. isopren ; c. Propin ; d. but-1-in 2. Viềt PTHH của phản ứng xảy ra khi cho các chất sau : propen , buta-1,3-dien , axetilen lần lượt tác dụng với H2, HX , Br2, H2O, AgNO3/NH3 3. Viết PTHH của phản ứng trùng hợp các chất sau : etilen , propilen , isopren ( theo kiểu 1,4 ) nêu ứng dụng của sản phẩm 4. Bằng phương pháp hóa học, hãy phân biệt các chất trong các trường hợp sau : a. Propan và propilen b. propilen và propin c. but-1-in và butadien d. but-1-in và but-2-in 5. Viết các PTHH thực hiện các biến đổi: a. CH4 🡪 C2H2 🡪 C4H4 🡪 C4H6 🡪 polibutadien b. CH4 🡪 C2H2 🡪 X🡪 Y🡪 Z🡪 PVC 6. Dẫn từ từ 3,36 lít hỗn hợp khí gồm etilen và propilen (đktc) vào dd brom thấy dd bị nhạt màu và khối lượng dd tăng thêm 5,25g .Tính thành phần % thể tích mỗi anken trong hỗn hợp (%V C2H4 =50, %V C3H6= 50 ) 7. Hỗn hợp X gồm etan, etilen và axetilen. Lầy V lít X cho lội chậm quadd AgNO3/NH3 dư thu được 2,4g kết tủa vàng nhạt .Cũng V lít X cho qua nước brom dư , thấy khối lượng nước brom tăng 0,82g và có 0,56 lít khí đi ra ngoài nước brom .Tính V và thành phần % thể tích mỗi khí trong X các khí đo ở (đktc) 8. Dẫn 6,72 lít hỗn hợp khí X gồm propan , etilen và axetilen qua dd brom dư , thấy còn 1,68 lít khí không bị hấp thụ .Nếu dẫn 6,72 lít khí X trên qua dd AgNO3/NH3 thấy có 24g kết tủa Các thể tích khí đo ở (đktc) .Tính thành phần % theo thể tích và theo khối lượng của mỗi khí trong hỗn hợp
BÀI TẬP TRẮC NGHIỆM Câu 1: Khi cho but-1-en tác dụng với dung dịch HBr, theo qui tắc Maccopnhicop sản phẩm nào sau đây là sản phẩm chính ? A. CH2Br-CH2-CH2-CH2Br . B. CH3-CH2-CHBr-CH2Br. C. CH3-CH2-CHBr-CH3. D. CH3-CH2-CH2-CH2Br. Câu 2: Sản phẩm trùng hợp propen là A. [-CH2-CH(CH3)]n-. B. -n[CH2-CH(CH3)]-. C. -n(CH2-CH(CH3))-. D. (-CH2-CH(CH3)-)n. Câu 3: Đốt cháy hoàn toàn 0,672 lít hidrocacbon A ( đktc) thu được 3,96 gam CO2, Biết A phản ứng được với AgNO3/NH3. CTPT của A là: A. C2H2 B. C5H8 C. C3H4 D. C4H6 Câu 4: Dãy các chất đều tham gia phản ứng trùng hợp là: A. Pent-1-en, isopren, propan. B. etilen, benzen, but-1-en, propan. C. propen, buta-1,3-đien, isopren D. etilen, etan, xiclopentan, butan Câu 5: anken C4H8 có số đồng phân cấu tạo là : A. 04 B. 03. C. 05. D. 06. Câu 6: Đốt cháy hoàn toàn 2,24 lít hiđrocacbon X thu được 6,72 lít CO2 (các thể tích khí đo ở ĐKC). X tác dụng với dung dịch AgNO3 trong NH3 sinh ra kết tủa Y . Công thức cấu tạo của X là A. CH3 –CH=CH2 B. CH≡CH C. CH3-C≡CH D. CH2=CH-CH≡CH Câu 7: Dãy các chất nào sau đây khi cho tác dụng với H2 dư ( Ni, to) đều cho một sản phẩm giống nhau: A. but-2-en, xiclobutan, but-1-in, buta-1,3- đien B. isopren, but-2-en, propen, buta-1,3- đien C. but-1-en, propen, isopren, but-1-in D. propen, pentan, butan, etilen Câu 8: Đốt cháy hoàn toàn 3,0 gam một hiđrocacbon X thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. Tỉ khối hơi của hiđrocacbon X so với hiđro là 15. Công thức phân tử của X là : A. C2H4 B. kết quả khác C. C2H6 D. C3H6 Câu 9: Đốt cháy hoàn toàn 2 hiđrocacbon X,Y kế tiếp nhau trong dãy đồng đẳng. Sản phẩm cháy qua bình 1 đựng dung dịch H2SO4 đặc, khối lượng tăng 2,52 gam và bình 2 đựng Ca(OH)2, khối lượng tăng 4,4 gam. CTPT của X và Y là: A. C2H6 và C3H8 B. C2H2 và C3H4 C. C3H8 và C4H10 D. C2H4 và C3H6 Câu 10: Cho sơ đồ phản ứng sau: CH3-C≡CH + AgNO3/ NH3  X + NH4NO3 X + NH4NO3 X có công thức cấu tạo là? A. CH3-CAg≡CAg. B. CH3-C≡CAg. C. AgCH2-C≡CAg. D. A, B, C đều có thể đúng. Câu 11: Cho 3,36 lít hỗn hợp etan và etilen (đktc) đi chậm qua qua dung dịch brom dư. Sau phản ứng khối lượng bình brom tăng thêm 2,8 gam. Số mol etan và etilen trong hỗn hợp lần lượt là: A. 0,12 và 0,03. B. 0,05 và 0,1. C. 0,03 và 0,12. D. 0,1 và 0,05. Câu 12: Hợp chất C5H12 mạch hở có bao nhiêu đồng phân cấu tạo ? A. 5. B. 6. C. 4. D. 3. Câu 13: Crackinh 17,4 gam butan thu được hỗn hợp X (gồm C4H10; C4H8; C3H6; C2H4, CH4; C2H6 và H2). Đốt cháy hỗn hợp X rồi cho toàn bộ sản phẩm cháy qua bình đựng dung dịch Ca(OH)2 dư. Khối lượng kết tủa thu được là: A. 80 g B. 120 g C. 100 g D. 60 g Câu 14: Hợp chất hữu cơ CH3-CH=C(CH3)-CH=CH2 có tên gọi là: A. 2- metylpent-2-en B. 3- metylpent-2-en C. 2-metylbuta-1,3- đien D. 3-metylpent-1,3- đien Câu 15: X là hỗn hợp khí gồm 2 hidrocacbon. Đốt cháy hoàn toàn 0,5 lít hỗn hợp X cho 0,75 lít CO2 và 0,75 lít hơi H2O ( các thể tích khí đo ở cùng điều kiện) CTPT của 2 hiđrocacbon đó là: A. C3H8 và C3H4 B. C2H4 và C2H2 C. C2H6 và C2H2 D. CH4 và C2H2 Câu 16: Để phân biệt propen, propin, propan. Người ta dùng các thuốc thử nào đây: A. dd AgNO3/NH3 và Ca(OH)2 B. dd KMnO4/ khí H2 C. dd AgNO3/NH3 và dd Br2 D. dd Br2và KMnO4 Câu 17: Chất 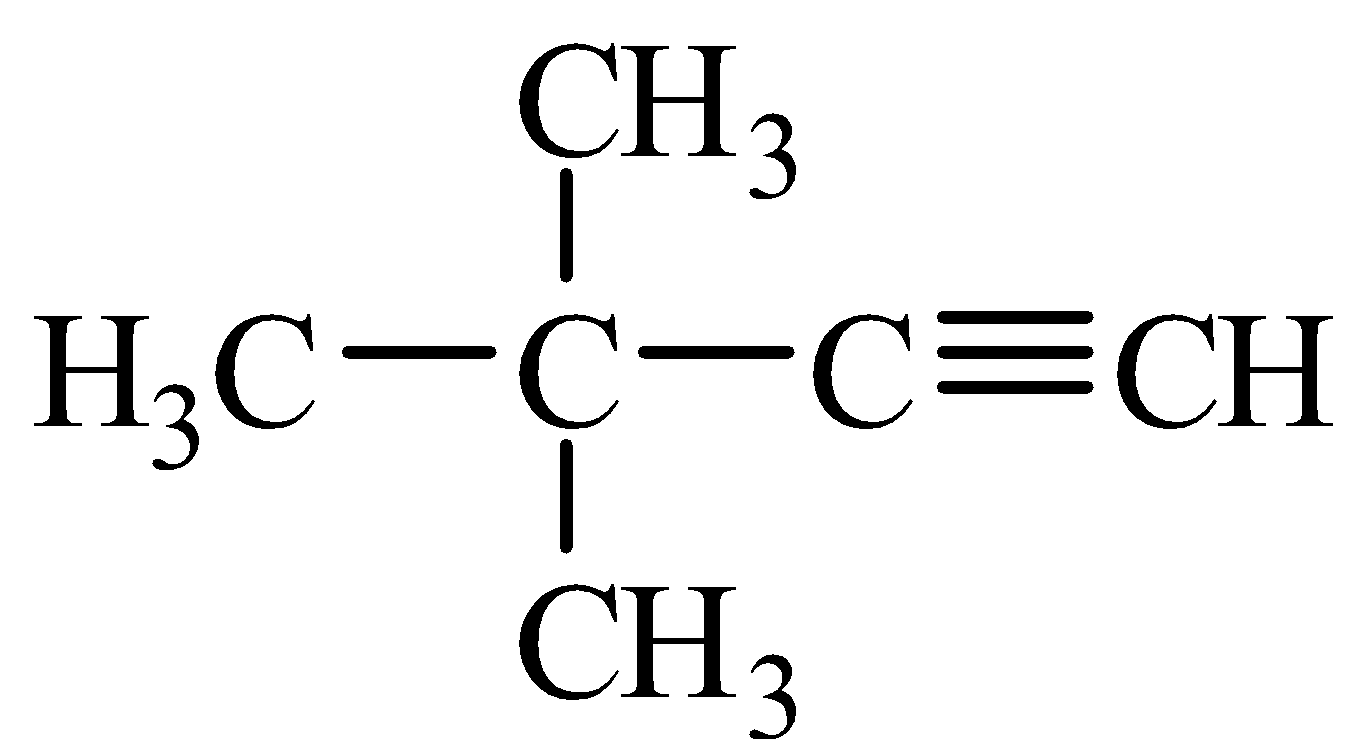 có tên là gì ? có tên là gì ? A. 2,2−Đimetylbut−1−in. B. 2,2−Đimeylbut −3−in. C. 3,3−Đimeylbut −1−in. D. 3,3−Đimeylbut −2−in. Câu 18: Đốt cháy hoàn toàn 2 ankin tạo ra 19,8 gam CO2 và 5,4 gam H2O. Thể tích O2 ( đktc) đã dùng là: A. 8.96 lít B. 11,2 lít C. 26,88 lít D. 13,44 lít Câu 19: Để nhận biết 3 khí C2H6, C2H4, C2H2 đựng trong 3 lọ mất nhãn, người ta dùng hoá chất nào dưới đây ? A. Dung dịch Br2 và nước brom C4H10. B. Dung dịch AgNO3/NH3 và nước brom C3H4. C. Dung dịch AgNO3/NH3C4H8. D. D. Dung dịch HCl và dung dịch Br2C2H6. Câu 20: Trong PTN khí C2H2 được điều chế từ chất nào sau đây? A. C2H6 B. CaC2 C. CH4 D. C2H4 Câu 21: Đồng trùng hợp buta-1,3- đien với acrylonitrin thu được polime có tên nào sau đây: A. P.V.C B. P.V.A C. Cao su buna-S D. Cao su buna-N Câu 22: : Cho hỗn hợp khí : pent-1-en ; pent-2-in ; pent-1-in sục vào dung dịch AgNO3/NH3 thu được một chất kết tủa màu vàng nhạt. Khí tham gia phản ứng là : A. pent-1-en. B. pent-1-in. C. pent-2-in. D. cả pent-1-in và pent-2-in. Câu 23: Chia hỗn hợp X chứa: axetilen và etilen thành 2 phần bằng nhau: Phần 1: Qua bình dựng dung dịch Br2 dư thì thấy khối lượng bình tăng 0,68 gam Phần 2: Đốt cháy hoàn toàn cần 1,568 lít O2 (đktc)
% thể tích mỗi khí trong hỗn hợp khí ban đầu lần lượt là: A. 40% và 60% B. 60% và 40% C. 50% và 50% D. 45% và 75% Câu 24: Đốt cháy hoàn toàn a gam hỗn hợp M gồm C4H10, C2H4, C3H6 thu được 8,96 lít CO2 (đktc) và 10,8 gam nước. a có giá trị là : A. 3,0 gam B. 6,0 gam C. 4,0 gam D. 5,0 gam Câu 25: Hợp chất nào sau đây có đồng phân hình học ? A. 2-clo-but-1-en. B. 2,3- đimetylpent-2-en. C. 2,3- điclobut-2-en. D. 2-metylbut-2-en. Câu 26: cho sơ đồ phản ứng sau: Al4C3→ X→ Y→ Z→ PVC X, Y, Z lần lượt là: A. C2H4, C2H6, C2H5Cl B. CH4, C2H2, CH2=CHBr C. C2H4, CH4, C2H2 D. CH4, C2H2 , CH2=CHCl Câu 27: Để phân biệt 2 chất lỏng là but-1-in và but-2-in người ta dùng thuốc thử nào sau đây: A. dd AgNO3/NH3 B. dd KMnO4 C. dd Br2 D. dd HBr Câu 28: Cho 14gam hỗn hợp gồm 2 anken là đồng đẳng kế tiếp đi qua dung dịch Br2 làm mất màu vừa đủ dung dịch chứa 64g Br2. CTPT của 2 anken là. ( Cho Br = 80) A. C3H6, C4H8 B. C3H6, C5H10 C. C4H8, C5H10 D. C2H4, C3H6 Câu 29: : Cho phản ứng giữa buta-1,3-đien và HBr ở -80oC (tỉ lệ mol 1:1), sản phẩm chính của phản ứng là A. CH3CHBrCH=CH2. B. CH3CH=CHCH2Br. C. CH2BrCH2CH=CH2. D. CH3CH=CBrCH3. Câu 30: Trùng hợp đivinyl tạo ra cao su Buna có cấu tạo là ? A. (-C2H-CH-CH-CH2-)n.B. (-CH2-CH=CH-CH2-)n.C. (-CH2-CH-CH=CH2-)n. D. (-CH2-CH2-CH2-CH2-)n. Câu 31: Một hỗn hợp A gồm 2 hiđrocacbon X, Y liên tiếp nhau trong cùng dãy đồng đẳng. Đốt cháy 11,2 lít hỗn hợp X thu được 57,2 gam CO2 và 23,4 gam CO2. CTPT X, Y và khối lượng của X, Y là: A. 5,6 gam C2H4 và 12,6 gam C3H6. B. 2,8 gam C2H4 và 16,8 gam C3H6. C. 12,6 gam C3H6 và 11,2 gam C4H8. D. 8,6 gam C3H6và 11,2 gam C4H8. Câu 32: Chất nào sau đây phản ứng được với dung dịch AgNO3/NH3: A. buta-1,3-đien B. stiren C. but-2-in D. propin Câu 33: Khi thực hện phản ứng monoclo hóa một ankan ( tỉ lệ mol 1:1) thì chỉ thu 1 sản phẩm thế duy nhất. Tên của ankan đó là: A. Pentan B. Butan C. 2,2- đimetylpropan D. 2,3- đimetylbutan Câu 34: Cho các chất sau: 2-metylbut-1-en (1); 3,3-đimetylbut-1-en (2); 3-metylpent-1-en (3); 3-metylpent-2-en (4); Những chất nào là đồng phân của nhau ? A. (1), (2) và (3). B. (1) và (2). C. (3) và (4). D. (2), (3) và (4). Câu 35: Đốt cháy hai hiđrocacbon là đồng đẳng liên tiếp của nhau ta thu được 6,3 gam nước và 9,68 gam CO2. Công thức phân tử của hai hiđrocacbon đó là A. CH4 và C2H6. B. C2H6 và C3H8. C. C2H4 và C3H6. D. C3H8 và C4H10. Câu 36: Thực hiện phản ứng cộng theo tỉ lệ mol 1:1 giữa 2-metylbuta-1,3-đien với HBr thì có thể thu được tối đa bao nhiêu sản phẩm khác nhau? A. 5 B. 6 C. 3 D. 4 Câu 37: Hợp chất hữu cơ X có tên gọi là: 2 - Clo - 3 - metylpentan. Công thức cấu tạo của X là: A. CH3CH2CH(Cl)CH(CH3)2 B. CH3CH(Cl)CH(CH3)CH2CH3 C. CH3CH2CH(CH3)CH2CH2Cl D. CH3CH(Cl)CH2CH(CH3)CH3 Câu 38: Những hợp chất nào sau đây có đồng phân hình học (cis-trans) ? CH3CH=CH2 (I); CH3CH=CHCl (II); CH3CH=C(CH3)2 (III); C2H5–C(CH3)=C(CH3)–C2H5 (IV); C2H5–C(CH3)=CCl–CH3 (V). A. (II), III, (IV), (V). B. (II), (IV), (V). C. (III), (IV). D. (I), (IV), (V). Câu 39: Hợp chất C5H10 mạch hở có bao nhiêu đồng phân cấu tạo ? A. 5. B. 6. C. 4. D. 10. Câu 40: Chất nào sau đây không làm mất màu dung dịch Br2? A. but-2-en B. propen C. axetilen D. propan Câu 41: Cho iso-pentan tác dụng với Cl2 theo tỉ lệ số mol 1 : 1, số sản phẩm monoclo tối đa thu được là A. 2 B. 3. C. 5. D. 4. Câu 42:khi cho 2-metylbutan tác dụng với Cl2 theo tỷ lệ mol 1:1 thì tạo ra sản phẩm chính là A. 1-clo-2-metylbutan. B. 2-clo-2-metylbutan. C. 2-clo-3-metylbutan. D. 1-clo-3-metylbutan.
CHƯƠNG 7 :HIDRO CACBON THƠM -NGUỒN HIDROCACBON THIÊN NHIÊN A. KIẾN THỨC CẦN NẮM VỮNG BENZEN VÀ DÃY ĐỒNG DẲNG - Định nghĩa , cấu trúc phân tử , đồng đẳng, đồng phân và danh pháp, t/chất vật lý, t/chất hóa học. B. MỘT SỐ CÂU HỎI VÀ BÀI TẬP THAM KHẢO 1. Viết CTCT và gọi tên các hidrocacbon thơm có CTPT C8H10 , C9H12 2. Viết các PTHH xảy ra (ghi rõ điều kiện phản ứng ) khi cho: benzen, toluen lần lượt tác dụng với Br2, HNO3 theo tỉ lệ 1:1. 3. Viết PTHH: stiren lần lượt tác dụng với nước brom, H2, trùng hợp 4. Bằng phương pháp hóa học, phân biệt các chất lỏng sau: a. Benzen, stiren , toluen b. Benzen , etylbenzen , hex-1-en 5. Cho benzen tác dụng với brom theo tỉ lệ mol 1:1 ( Fe xúc tác ) thu được sản phẩm gồm chất lỏng B và khí C. Hấp thụ C vào 2 lít dd NaOH 0,5M .Để trung hoà NaOH dư, cần 0,5 lít dd HCl 1M. Tính khối lượng bezen phản ứng và khối lượng chất B? 6. Hidrocacbon X là đồng đẳng của benzen có % khối lượng C bằng 90,56% . Hãy xác định CTPT của X? TRẮC NGHIỆM Câu 1. Công thức tổng quát dãy đồng đẳng của benzen là A. CnH2n+1( n ) B. CnH2n+2( n ) B. CnH2n+2( n ) C. CnH2n-6( n ) C. CnH2n-6( n ) D. CnH2n( n ) D. CnH2n( n ) ) Câu 2. Chất nào sau đây thuộc dãy đồng đẳng của benzen? A. C6H5CH3 B. C6H11CH3 C. C6H11CH2CH3 D. C6H5OH
Câu 3. Tính thơm của benzen và dãy đồng đẳng của benzen thể hiện là A. Dễ tham gia phản ứng cộng, khó tham gia phản ứng thế B. Dễ tham gia phản ứng cộng, khó tham gia phản ứng oxi hóa C. Dễ tham gia phản ứng thế, khó tham gia phản ứng cộng, bền vững với chất oxi hóa D. Dễ tham gia phản ứng với chất oxi hóa, halogen ở nhiệt độ thường Câu 4. ở điều kiện thích hợp, benzen tácdụng được với tất cả các chất trong nhóm nào sau đây ? A. brom khan, khí Clo, dd thuốc tím , hidro B. brom khan, khí clo, hỗn hợp HNO3đ và H2SO4đ, hidro C. hỗn hợp HNO3 đ và H2SO4đ, KMnO4, hidro D. dd brom, hỗn hợp HNO3đ và H2SO4đ, hidro Câu 5. Ở điều kiện thích hợp, toluen tác dụng được với tất cả các chất trong nhóm nào sau đây ? A. ddbrom , dd thuốc tím, hidro, oxi B. brom khan, hỗn hợp HNO3đặc và H2SO4đ, oxi, hidro, ddKMnO4 C. hỗn hợp HNO3đặc và H2SO4đ, KMnO4,hidro, oxi, nước Clo D. ddBrom, hỗn hợp HNO3đặc và H2SO4đ, oxi, ddKMnO4 Câu 6. Toluen phản ứng thế ở nhân benzen với các chất tương tự benzen nhưng khác với benzen A. phản ứng của toluen xảy ra chậm hơn và chỉ có một sản phẩm duy nhất B. phản ứng của toluen xảy ra chậm hơn và thường có 2 sản phẩm C. phản ứng của toluen xảy ra dễ dàng hơn và thường có 2 sản phẩm thế vào vị trí ortho và para D. phản ứng của toluen xảy ra nhanh hơn và chỉ có một sản phẩm duy nhất Câu 7. Nhóm sản phẩm nào sau đây là của phản ứng giữa toluen với brom khan có bột sắt làm xúc tác? 1. o-bromtoluen 2. p-bromtoluen 3. benzyl bromua 4. etylbrombenzen A. 1,3 B. 2,3 C.1,4 D. 1,2 Câu 8. Có thể dùng chất nào sau đây để phân biệt 2 chất lỏng là benzen và toluen? A. brom khan và bột sắt B. dd brom C. hỗn hợp HNO3 đặc và H2SO4đ D. dd thuốc tím, đun nóng Câu 9. Cho 0,78g benzen vào ống nghiệm chứa sẵn hỗn hợp HNO3đặc và H2SO4đặc dư và lắc mạnh thu được một chất lỏng nặng màu vàng nhạt. Khối lượng chất lỏng đó là A. 12,3g B. 6,15g C. 1,23g D. 0,123g Câu 10. Khi đốt cháy hoàn toàn hiđrocacbon lỏng X thu được tỉ lệ thể tích V CO2: VH2O = 2:1. CTPT của X là A. C5H12 B. C5H10 C. C6H6 D. C2H2 Câu 11. Kết luận nào sau đây không đúng ? A. stiren không làm mất màu dd thuốc tím B. Stiren còn có tên là vinylbenzen C. các nguyên tử trong phân tử stiren cùng nằm trên một mặt phẳng D. Stiren vừa có tính chất giống anken vừa có tính chất giống bezen Câu 12. Tính chất hóa học của stiren là A. làm mất màu dd brom B. làm mất màu dd thuốc tím C. có phản ứng trùng hợp , đồng trùng hợp D. tất cả A,B,C đều đúng Câu 13. Khi cho hợp chất hữu cơ X vào dd brom thì thấy dd brom nhạt màu, tạo thành hợp chất C8H8 Br2. Chất X là A. C6H5CH2CH=CH2 B. C6H5C2H5 C. C6H5CH=CH2 D. C6H5CH3 Câu 14. Cho sơ đồ điều chế polistiren như sau: Khí thiên nhiên  C2H2 C2H2  X X 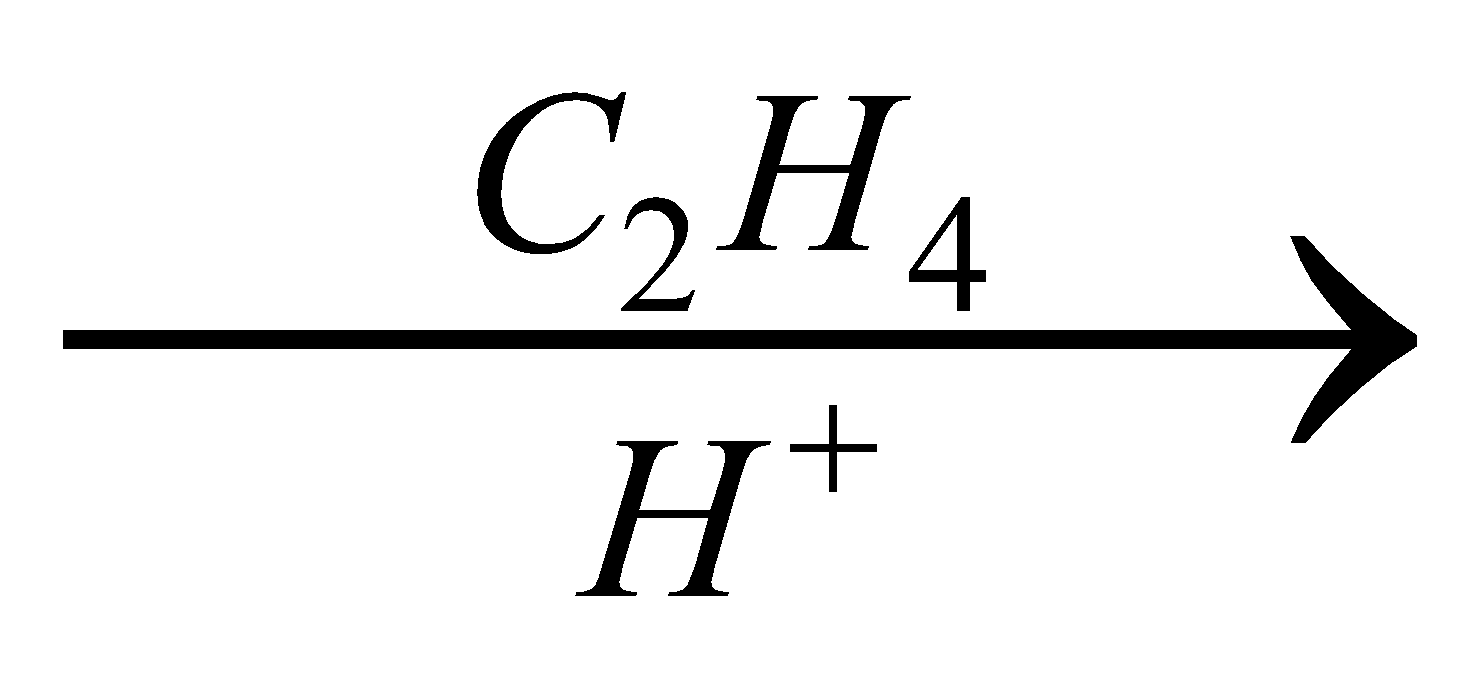 C6H5C2H5 C6H5C2H5 Y Y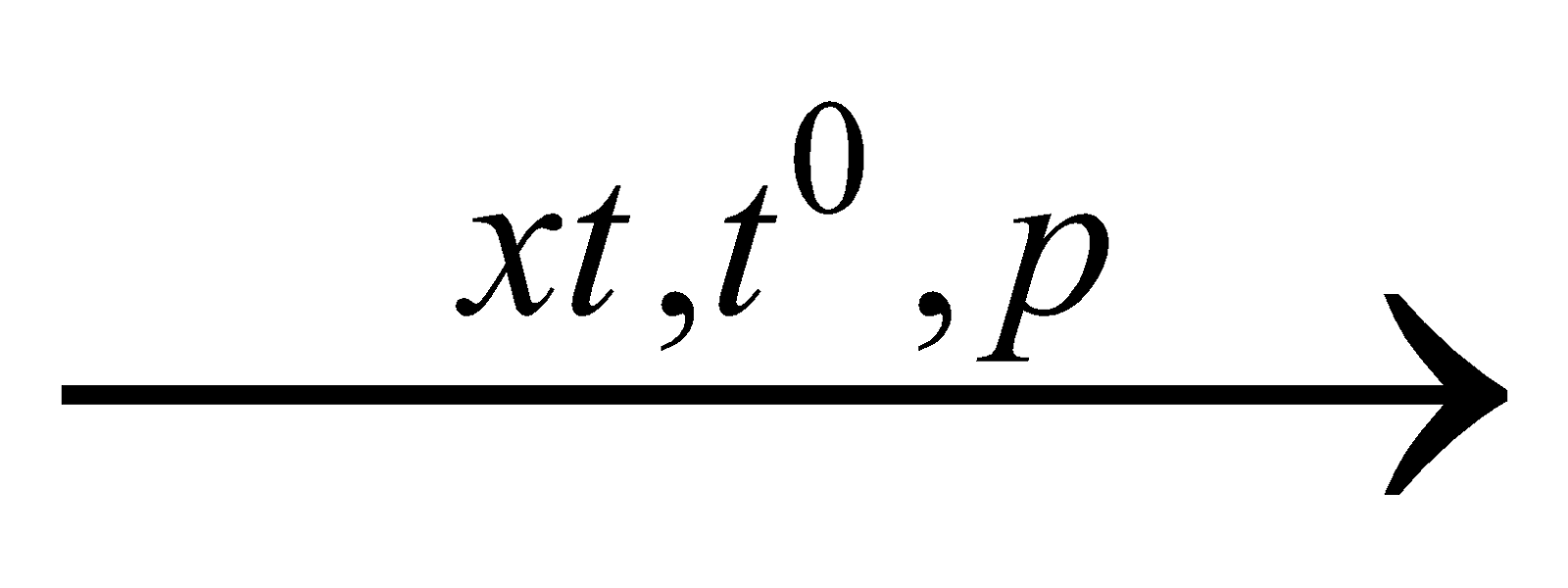 PS. X,Y tương ứng là PS. X,Y tương ứng là A. C6H6 và C7H8 B. C6H6 và C8H8 C. C2H4 và C8H8 D. C4H6 và C8H10 Câu 15. Phản ứng hóa học nào sau đây xảy ra trong quá trình cracking? A. C4H10  C2H6 + C2H4 C2H6 + C2H4 B. CH3-[CH2]4–CH3  CH3-CH(CH3) CH2CH2CH=CH2 CH3-CH(CH3) CH2CH2CH=CH2 C. CH3-[CH2]4–CH3 xiclohexan +H2 xiclohexan +H2 D. Xiclohexan  benzen + 3H2 benzen + 3H2
ANCOL - PHENOL Câu 1: Ancol no, đơn chức, mạch hở có công thức chung là A. CnH2n - 1OH (n≥3). B. CnH2n +1CHO (n≥0). C. CnH2n + 1COOH (n≥0). D. CnH2n + 1OH (n≥1). Câu 2: Bậc của ancol là A. bậc cacbon lớn nhất trong phân tử. B. bậc của cacbon liên kết với nhóm -OH. C. số nhóm chức có trong phân tử. D. số cacbon có trong phân tử ancol. Câu 3: Có bao nhiêu đồng phân ancol có công thức phân tử là C4H10O ? A. 6. B. 7. C. 4. D. 5. Câu 4: Số đồng phân ancol ứng với CTPT C5H12O là A. 8. B. 7. C. 5. D. 6. Câu 5: Dãy gồm các chất đều phản ứng được với C2H5OH là A. Na, Fe, HBr. B. CuO, KOH, HBr. C. NaOH, Na, HBr. D. Na, HBr, CuO. Câu 6: Khi lên men 180 gam glucozơ với hiệu suất 80%, khối lượng ancol etylic thu được là A. 147,2 gam. B. 276 gam. C. 92 gam. D. 184 gam. Câu 7: Khi oxi hóa 6,9 gam ancol etylic bởi CuO, t o thu được lượng andehit axetic với hiệu suất 80 % là : A. 6,6g B. 8,25g C. 5,28g D. 3,68g Câu 8: ancol etylic tan trong nước vì : Phản ứng với nước. B. Tạo được liên kết hidro với nước.
C. Điện li thành ion. D. Cho được liên kết hidro với ancol . Câu 9: Số lượng các đồng phân ancol có công thức phân tử C5H12O là : A. 6. B. 7. C. 8. D. 9 Câu 10: Ancol đơn no chúa 6 nguyên tử cacbon có số lượng đồng phân ancol bậc một là : A. 5 B. 6 C. 7 D. 8 Câu 11: Phản ứng nào sau đây không xảy ra : C2H5OH + HBr B. C2H5OH + NaOH. C. C2H5OH + Na D.C2H5OH + CuO
Câu 12: Đốt cháy hoàn toàn m gam ancol no đơn chức mạch hở, sau phản ứng thu được 4,48 lít CO2 (đktc) và 5,4 gam nước. Công thức của ancol là: A. C2H5OH B. C3H7OH C. CH3OH D. C4H9OH Câu 13: Đun nóng ancol etylic với axit sufuric đặc ở 1400C, thu được sản phẩm chính là: A. C2H6 B. C2H4 C. (CH3)2O D. (C2H5)2O Câu 14 : Khi đun nóng ancol etylic với H2SO4 đặc ở 1700C thì sẽ tạo ra sản phẩm chính là A. CH3COOH. B. CH3CHO. C. C2H4. D. C2H5OC2H5 Câu 15: Cho 3,5 gam hỗn hợp 2 ancol đơn chức tác dụng với Na vừa đủ thu được 1,12 lít H2 ở đktc. Sau phản ứng cô cạn thu được m gam muối. Giá trị m là : A. 5,7 gam B. 6,2 gam C. 7,5 gam D. 4,2 gam Câu 16: Thuốc thử dùng để phân biệt etanol và phenol là A. dung dịch NaOH B. dung dịch brom C. Cu(OH)2 D. A và B đều đúng Câu 17: Oxi hóa rượu bằng CuO đun nóng thu được xeton, thì rượu đó là rượu bậc : 1 B. 2 C.3 D. Cả A, B, C đúng
Câu 18: Đốt cháy một ancol đơn chức, mạch hở X thu được CO2 và hơi nước theo tỉ lệ thể tích 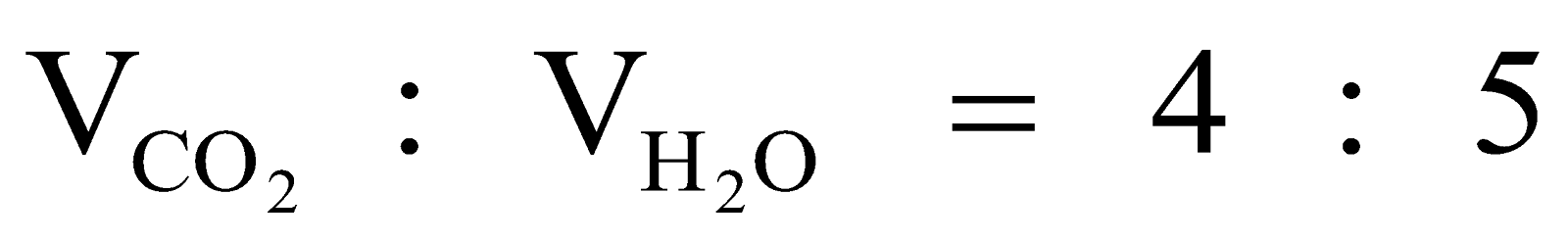 . CTPT của X là . CTPT của X là A. C4H10O. B. C3H6O. C. C5H12O. D. C2H6O. Câu 19: Đun nóng hỗn hợp X gồm 0,1 mol CH3OH và 0,2 mol C2H5OH với H2SO4 đặc ở 140oC, khối lượng ete thu được là A. 12,4 gam. B. 7 gam. C. 9,7 gam. D. 15,1 gam. Câu 20: Đốt cháy hoàn toàn m gam ancol đơn chức A được 6,6 gam CO2 và 3,6 gam H2O. Giá trị m là A. 10,2 gam. B. 2 gam. C. 2,8 gam. D. 3 gam. Câu 21: Đề hiđrat hóa 14,8 gam ancol thu được 11,2 gam anken. CTPT của ancol là A. C2H5OH. B. C3H7OH. C. C4H9OH. D. CnH2n + 1OH. Câu 22: Cho 7,6 gam một ancol no, đơn chức tác dụng với Na vừa đủ. Sau phản ứng thu được V lít khí H2 và cô cạn được 10,9 gam muối. Giá trị của V là A. 1,68 B. 2,24 C. 3,36 D. 2,8 Câu 23: Một ancol no đơn chức có %H = 13,04% về khối lượng. CTPT của ancol là A. C6H5CH2OH. B. CH3OH. C. C2H5OH. D. CH2=CHCH2OH Câu 24: Đốt cháy hoàn toàn m gam ancol no đơn chức mạch hở, sau phản ứng thu được 4,48 lít CO2 (đktc) và 5,4 gam nước. Công thức của ancol là: A. C2H5OH B. C3H7OH C. CH3OH D. C4H9OH Câu 25: Cho 4,6 gam ancol etylic phản ứng hoàn toàn với Na (dư) thu được V lít khí H2 (đktc). Giá trị của V là: (C = 12, H = 1, O = 16) A. 2,24 B. 4,48 C. 3,36 D. 1,12 Câu 26: Cho 4,6 gam ancol etylic phản ứng hoàn toàn với Na (dư) thu được V lít khí H2 (đktc). Giá trị của V là: (C = 12, H = 1, O = 16) A. 2,24 B. 4,48 C. 3,36 D. 1,12 Câu 27: Cho 6,4 gam ancol metylic phản ứng hoàn toàn với Na (dư) thu được V lít khí H2 (ở đktc). Giá trị của V là A. 2,24. B. 1,12. C. 4,48. D. 3,36. Câu 28: Cho 3,70 gam một ancol X no, đơn chức, mạch hở tác dụng với natri vừa đủ thấy có 0,56 lít khí thoát ra (ở đktc). Sau phản ứng cô cạn thu được m g muối, giá trị của m là: A. 4,2 B. 4,8 C. 5,2 D. 6 Câu 29: Đốt cháy hoàn toàn 6g một ancol no, đơn, hở X thu được 13,2g CO2. CTPT của X là A. CH3OH B. C2H5OH C. C3H7OH. D. C4H9OH Câu 30: Cho m gam glucozơ C6H12O6 lên men thành rượu etylic với H=80%. Hấp thu toàn bộ khí CO2 vào dd nước vôi trong dư thu 20 g kết tủa .giá trị của m là A. 45. B. 11,25. C. 14,4. D. 22,5. PHENOL Câu 31: Phát biểu nào sau đây sai A. Phênol là axit yếu ,nhưng tính axit vẫn mạnh hơn axit cacboxylic B. Phênol là một axit yếu, không làm đổi màu quỳ tím C. Phênol cho kết tủa trắng với dd nước brôm D. Phênol rất ít tan trong nước lạnh Câu 32: Chất thơm không td với dd NaOH là A. C6H5CH2OH B. p-CH3C6H4OH C. C6H5OH D. C6H5NH3Cl Câu 33: Để điều chế natriphenolat thì cho phenol tác dụng với A. Na. B. NaOH. C. NaHCO3. D. Na hoặc NaOH. Câu 34: Phenol (C6H5OH) tác dụng được với: A. CH4. B. NaCl. C. NaOH. D. NaNO3. Câu 35: Chọn câu đúng: “Phenol có thể tác dụng với …” A. HCl và Na B. Na và NaOH. C. NaOH và HCl. D. Na và Na2CO3. Câu 36: Hóa chất duy nhất dùng để nhận biết 3 chất lỏng đựng riêng biệt trong ba bình mất nhãn: phenol, stiren và rượu etylic là... A. natri kim loại. B. quỳ tím. C. dung dịch naOH. D. dung dịch brom Câu 37: Hãy chọn câu đúng khi so sánh tính chất hóa học khác nhau giữa ancol etylic và phenol . cả hai đều phản ứng được với dung dịch NaOH. Cả hai đều phản ứng được với axit HBr. Ancol etylic phản ứng được với NaOH còn phenol thì không. Phenol phản ứng với dung dịch NaOH còn ancol etylic thì không.
Câu 38: Phát biểu nào sau đây sai : Phenol là axit yếu, không làm đổi màu quỳ tím. Phenol là axit yếu, nhưng tính axit vẫn mạnh hơn axit cacbonic. Phenol cho kết tủa trắng với dung dịch nước brom. Phenol rất ít tan trong nước lạnh
Câu 39: Cho các phát biểu sau: (1) Phenol C6H5-OH là một rựơu thơm. (2) Phenol tham gia phản ứng thế brom và thế nitro NO2 dễ hơn benzen. (3) Phenol tác dụng được với natri hidroxit tạo thành muối và nước. (4) Trong phân tử phenol có sự ảnh hưởng qua lại giữa nhóm –OH và vòng benzen. Số phát biểu đúng làA. 1. B. 2. C. 3. D. 4. Câu 40: Khi cho Phenol tác dụng với nước brom, ta thấy: mất màu nâu đỏ của nước brom. B. tạo kết tủa đỏ gạch.
C. tạo kết tủa trắng. D. tạo kết tủa xám bạc. Câu 41: Dãy gồm các chất đều phản ứng với phenol là A. dung dịch NaCl, dung dịch NaOH, kim loại Na.B. nước brom, axit axetic, dung dịch NaOH. C. nước brom, HNO3, dung dịch NaOH. D. nước brom, anđehit axetic, dung dịch NaOH. Câu 42: Cho lần lượt các chất C3H5(OH)3, C2H5OH, C6H5OH pư với Cu(OH)2. Hỏi mấy chất không phản ứng? A. Không chất nào. B. Một chất. C. Hai chất D. Cả 3 chất. Câu 43: Nhúng quỳ tím vào ống nghiệm đựng phenol, thấy: A. Quỳ tím hóa đỏ B. Quỳ tím hóa xanh C. Quỳ tím không đổi màu D. Quỳ tím hóa thành màu hồng Câu 44: Trong các chất sau ,chất nào có nhiệt độ sôi cao nhất A. phenol B. etanol C. đimetyl ete D. metanol Câu 45: Cho các chất sau: phenol, etanol và glixerol. kết luận nào sau đây là đúng? A. có một chất td được với Na B. có hai chất td được với dd NaOH C. cả ba chất đều td được với dd Na2CO3 D. cả ba chất đều tan tốt trong nước Câu 46: Ảnh hưởng của nhóm -OH đến gốc C6H5- trong phân tử phenol thể hiện qua phản ứng giữa phenol với A. dung dịch NaOH. B. Na kim loại. C. nước Br2. D. H2 (Ni, t0C). Câu 47: Cho các hợp chất sau : (a) HOCH2CH2OH. (b) HOCH2CH2CH2OH. (c) HOCH2CH(OH)CH2OH. (d) CH3CH(OH)CH2OH. (e) CH3CH2OH. (f) CH3OCH2CH3. Các chất đều tác dụng được với Na, Cu(OH)2 là A. (a), (b), (c). B. (c), (d), (f). C. (a), (c), (d). D. (c), (d), (e). Câu 48: Trong các chất dưới đây, chất nào là ancol A. C6H5OH B. CH3COOH C. C6H5CH2OH D. CH3CH2OCH3 Câu 49: Tên quốc tế của hợp chất có công thức CH3CH(C2H5)CH(OH)CH3 là A. 4-etyl pentan-2-ol. B. 2-etyl butan-3-ol. C. 3-etyl hexan-5-ol. D. 3-metyl pentan-2-ol. Câu 50: Cho ancol có CTCT: CH3-CH(CH3)-CH2-CH2-CH2-OH. Tên nào dưới đây ứng với ancol trên A. 2-metylpentan-1-ol B. 4-metylpentan-1-ol C. 4-metylpentan-2-ol D. 3-metylhexan-2-ol Câu 51: Các ancol (CH3)2CHOH ; CH3CH2OH ; (CH3)3COH có bậc ancol lần lượt là A. 1, 2, 3. B. 1, 3, 2. C. 2, 1, 3. D. 2, 3, 1. Câu 52: Cho m gam phenol tác dụng với natri dư thấy thoát ra 5,6 lít khí H2 (đktc). Giá trị m là A. 47. B. 23,5. C. 47,5. D. 23,75. Câu 53: Cho nước brom dư vào dung dịch chứa m gam phenol thu được 6,62 gam kết tủa trắng (phản ứng hoàn toàn). Giá trị m làA. 1,88. B. 8,18. C. 8,81. D. 18,8. Câu 54: Cho 1,88 gam phenol tác dụng vừa đủ với V ml dung dịch NaOH 1M. Giá trị của V là:
A. 30 ml B. 10 ml C. 20 ml D. 40 ml
TỔ HÓA 11 ĐỀ CƯƠNG ÔN TẬP MÔN HÓA HỌC LỚP 11 HỌC KÌ II CHƯƠNG 5: HIĐROCACBON NO A. KIẾN THỨC CẦN NẮM VỮNG Định nghĩa ankan, công thức chung, đồng đẳng, đồng phân, danh pháp, tcvl, tchh, điều chế, ứng dụng. B. MỘT SỐ CÂU HỎI VÀ BÀI TẬP THAM KHẢO 1. Viết công thức cấu tạo các đồng phân ankan ứng với công thức phân tử C4H10, C5H12 và C6H14. Gọi tên theo danh pháp thường và tên thay thế. 2. Viết CTCT của các ankan có tên sau: a. pentan, 2-metylbutan, isobutan và 2,2-đimetylbutan. ; b. iso-pentan, neo-pentan, 3-etylpentan, 2,3-đimetylpentan. 3. Gọi tên các chất sau theo danh pháp thường và danh pháp thay thế: a. CH3-CH(CH3)-CH3 b. CH3-(CH2)4-CH3 c. CH3-CH(CH3)-CH2-CH3 d. CH3-C(CH3)2-CH3 4. Hoàn thành các PTHH của các phản ứng sau: a. C2H6 + Cl2 (1:1)  c. CH3-CH2-CH3 + Br2 (1:1) c. CH3-CH2-CH3 + Br2 (1:1) b. CH4 + O2  d. CH3COONa + NaOH d. CH3COONa + NaOH  5. Khi clo hóa C5H12 với tỷ lệ mol 1:1 thu được một sản phẩm thế monoclo duy nhất. a. Xác định CTCT và danh pháp thay thế của ankan đó. b. Viết PTHH của phản ứng xảy ra. 6. Đốt cháy hoàn toàn 2,24 lít ankan X (đktc) thu được 6,72 lít khí CO2 (đktc) và m gam nước. a. Xác định công thức của X. b. Tính khối lượng nước thu được 7. Đốt cháy hoàn toàn 2,24 lít ankan B (đktc) cần 11,2 lít O2 (đktc). a. Xác định công thức của B. b. Tính khối lượng CO2 và nước sinh ra. 8. Đốt cháy hoàn toàn 3,36 lít hỗn hợp khí metan và etan thu được 4,48 lít khí CO2 (đktc). Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A. CHƯƠNG 6 : HIDROCACBON KHÔNG NO A. KIẾN THỨC CẦN NẮM VỮNG ANKEN: Định nghĩa, công thức chung ,đồng đẳng, đồng phân, danh pháp, tchh, điều chế, ứng dụng. ANKAĐIEN: Định nghĩa , công thức chung, đồng đẳng, đồng phân, danh pháp, tchh, điều chế, ứng dụng ANKIN: Định nghĩa , công thức chung, đồng đẳng, đồng phân, danh pháp, tchh, điều chế, ứng dụng B. MỘT SỐ CÂU HỎI VÀ BÀI TẬP VẬN DỤNG 1. Viết CTCT các chất sau: a. buta-1,3-dien ; b. isopren ; c. Propin ; d. but-1-in 2. Viềt PTHH của phản ứng xảy ra khi cho các chất sau : propen , buta-1,3-dien , axetilen lần lượt tác dụng với H2, HX , Br2, H2O, AgNO3/NH3 3. Viết PTHH của phản ứng trùng hợp các chất sau : etilen , propilen , isopren ( theo kiểu 1,4 ) nêu ứng dụng của sản phẩm 4. Bằng phương pháp hóa học, hãy phân biệt các chất trong các trường hợp sau : a. Propan và propilen b. propilen và propin c. but-1-in và butadien d. but-1-in và but-2-in 5. Viết các PTHH thực hiện các biến đổi: a. CH4 🡪 C2H2 🡪 C4H4 🡪 C4H6 🡪 polibutadien b. CH4 🡪 C2H2 🡪 X🡪 Y🡪 Z🡪 PVC 6. Dẫn từ từ 3,36 lít hỗn hợp khí gồm etilen và propilen (đktc) vào dd brom thấy dd bị nhạt màu và khối lượng dd tăng thêm 5,25g .Tính thành phần % thể tích mỗi anken trong hỗn hợp (%V C2H4 =50, %V C3H6= 50 ) 7. Hỗn hợp X gồm etan, etilen và axetilen. Lầy V lít X cho lội chậm quadd AgNO3/NH3 dư thu được 2,4g kết tủa vàng nhạt .Cũng V lít X cho qua nước brom dư , thấy khối lượng nước brom tăng 0,82g và có 0,56 lít khí đi ra ngoài nước brom .Tính V và thành phần % thể tích mỗi khí trong X các khí đo ở (đktc) 8. Dẫn 6,72 lít hỗn hợp khí X gồm propan , etilen và axetilen qua dd brom dư , thấy còn 1,68 lít khí không bị hấp thụ .Nếu dẫn 6,72 lít khí X trên qua dd AgNO3/NH3 thấy có 24g kết tủa Các thể tích khí đo ở (đktc) .Tính thành phần % theo thể tích và theo khối lượng của mỗi khí trong hỗn hợp
BÀI TẬP TRẮC NGHIỆM Câu 1: Khi cho but-1-en tác dụng với dung dịch HBr, theo qui tắc Maccopnhicop sản phẩm nào sau đây là sản phẩm chính ? A. CH2Br-CH2-CH2-CH2Br . B. CH3-CH2-CHBr-CH2Br. C. CH3-CH2-CHBr-CH3. D. CH3-CH2-CH2-CH2Br. Câu 2: Sản phẩm trùng hợp propen là A. [-CH2-CH(CH3)]n-. B. -n[CH2-CH(CH3)]-. C. -n(CH2-CH(CH3))-. D. (-CH2-CH(CH3)-)n. Câu 3: Đốt cháy hoàn toàn 0,672 lít hidrocacbon A ( đktc) thu được 3,96 gam CO2, Biết A phản ứng được với AgNO3/NH3. CTPT của A là: A. C2H2 B. C5H8 C. C3H4 D. C4H6 Câu 4: Dãy các chất đều tham gia phản ứng trùng hợp là: A. Pent-1-en, isopren, propan. B. etilen, benzen, but-1-en, propan. C. propen, buta-1,3-đien, isopren D. etilen, etan, xiclopentan, butan Câu 5: anken C4H8 có số đồng phân cấu tạo là : A. 04 B. 03. C. 05. D. 06. Câu 6: Đốt cháy hoàn toàn 2,24 lít hiđrocacbon X thu được 6,72 lít CO2 (các thể tích khí đo ở ĐKC). X tác dụng với dung dịch AgNO3 trong NH3 sinh ra kết tủa Y . Công thức cấu tạo của X là A. CH3 –CH=CH2 B. CH≡CH C. CH3-C≡CH D. CH2=CH-CH≡CH Câu 7: Dãy các chất nào sau đây khi cho tác dụng với H2 dư ( Ni, to) đều cho một sản phẩm giống nhau: A. but-2-en, xiclobutan, but-1-in, buta-1,3- đien B. isopren, but-2-en, propen, buta-1,3- đien C. but-1-en, propen, isopren, but-1-in D. propen, pentan, butan, etilen Câu 8: Đốt cháy hoàn toàn 3,0 gam một hiđrocacbon X thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. Tỉ khối hơi của hiđrocacbon X so với hiđro là 15. Công thức phân tử của X là : A. C2H4 B. kết quả khác C. C2H6 D. C3H6 Câu 9: Đốt cháy hoàn toàn 2 hiđrocacbon X,Y kế tiếp nhau trong dãy đồng đẳng. Sản phẩm cháy qua bình 1 đựng dung dịch H2SO4 đặc, khối lượng tăng 2,52 gam và bình 2 đựng Ca(OH)2, khối lượng tăng 4,4 gam. CTPT của X và Y là: A. C2H6 và C3H8 B. C2H2 và C3H4 C. C3H8 và C4H10 D. C2H4 và C3H6 Câu 10: Cho sơ đồ phản ứng sau: CH3-C≡CH + AgNO3/ NH3  X + NH4NO3 X + NH4NO3 X có công thức cấu tạo là? A. CH3-CAg≡CAg. B. CH3-C≡CAg. C. AgCH2-C≡CAg. D. A, B, C đều có thể đúng. Câu 11: Cho 3,36 lít hỗn hợp etan và etilen (đktc) đi chậm qua qua dung dịch brom dư. Sau phản ứng khối lượng bình brom tăng thêm 2,8 gam. Số mol etan và etilen trong hỗn hợp lần lượt là: A. 0,12 và 0,03. B. 0,05 và 0,1. C. 0,03 và 0,12. D. 0,1 và 0,05. Câu 12: Hợp chất C5H12 mạch hở có bao nhiêu đồng phân cấu tạo ? A. 5. B. 6. C. 4. D. 3. Câu 13: Crackinh 17,4 gam butan thu được hỗn hợp X (gồm C4H10; C4H8; C3H6; C2H4, CH4; C2H6 và H2). Đốt cháy hỗn hợp X rồi cho toàn bộ sản phẩm cháy qua bình đựng dung dịch Ca(OH)2 dư. Khối lượng kết tủa thu được là: A. 80 g B. 120 g C. 100 g D. 60 g Câu 14: Hợp chất hữu cơ CH3-CH=C(CH3)-CH=CH2 có tên gọi là: A. 2- metylpent-2-en B. 3- metylpent-2-en C. 2-metylbuta-1,3- đien D. 3-metylpent-1,3- đien Câu 15: X là hỗn hợp khí gồm 2 hidrocacbon. Đốt cháy hoàn toàn 0,5 lít hỗn hợp X cho 0,75 lít CO2 và 0,75 lít hơi H2O ( các thể tích khí đo ở cùng điều kiện) CTPT của 2 hiđrocacbon đó là: A. C3H8 và C3H4 B. C2H4 và C2H2 C. C2H6 và C2H2 D. CH4 và C2H2 Câu 16: Để phân biệt propen, propin, propan. Người ta dùng các thuốc thử nào đây: A. dd AgNO3/NH3 và Ca(OH)2 B. dd KMnO4/ khí H2 C. dd AgNO3/NH3 và dd Br2 D. dd Br2và KMnO4 Câu 17: Chất  có tên là gì ? có tên là gì ? A. 2,2−Đimetylbut−1−in. B. 2,2−Đimeylbut −3−in. C. 3,3−Đimeylbut −1−in. D. 3,3−Đimeylbut −2−in. Câu 18: Đốt cháy hoàn toàn 2 ankin tạo ra 19,8 gam CO2 và 5,4 gam H2O. Thể tích O2 ( đktc) đã dùng là: A. 8.96 lít B. 11,2 lít C. 26,88 lít D. 13,44 lít Câu 19: Để nhận biết 3 khí C2H6, C2H4, C2H2 đựng trong 3 lọ mất nhãn, người ta dùng hoá chất nào dưới đây ? A. Dung dịch Br2 và nước brom C4H10. B. Dung dịch AgNO3/NH3 và nước brom C3H4. C. Dung dịch AgNO3/NH3C4H8. D. D. Dung dịch HCl và dung dịch Br2C2H6. Câu 20: Trong PTN khí C2H2 được điều chế từ chất nào sau đây? A. C2H6 B. CaC2 C. CH4 D. C2H4 Câu 21: Đồng trùng hợp buta-1,3- đien với acrylonitrin thu được polime có tên nào sau đây: A. P.V.C B. P.V.A C. Cao su buna-S D. Cao su buna-N Câu 22: : Cho hỗn hợp khí : pent-1-en ; pent-2-in ; pent-1-in sục vào dung dịch AgNO3/NH3 thu được một chất kết tủa màu vàng nhạt. Khí tham gia phản ứng là : A. pent-1-en. B. pent-1-in. C. pent-2-in. D. cả pent-1-in và pent-2-in. Câu 23: Chia hỗn hợp X chứa: axetilen và etilen thành 2 phần bằng nhau: Phần 1: Qua bình dựng dung dịch Br2 dư thì thấy khối lượng bình tăng 0,68 gam Phần 2: Đốt cháy hoàn toàn cần 1,568 lít O2 (đktc)
% thể tích mỗi khí trong hỗn hợp khí ban đầu lần lượt là: A. 40% và 60% B. 60% và 40% C. 50% và 50% D. 45% và 75% Câu 24: Đốt cháy hoàn toàn a gam hỗn hợp M gồm C4H10, C2H4, C3H6 thu được 8,96 lít CO2 (đktc) và 10,8 gam nước. a có giá trị là : A. 3,0 gam B. 6,0 gam C. 4,0 gam D. 5,0 gam Câu 25: Hợp chất nào sau đây có đồng phân hình học ? A. 2-clo-but-1-en. B. 2,3- đimetylpent-2-en. C. 2,3- điclobut-2-en. D. 2-metylbut-2-en. Câu 26: cho sơ đồ phản ứng sau: Al4C3→ X→ Y→ Z→ PVC X, Y, Z lần lượt là: A. C2H4, C2H6, C2H5Cl B. CH4, C2H2, CH2=CHBr C. C2H4, CH4, C2H2 D. CH4, C2H2 , CH2=CHCl Câu 27: Để phân biệt 2 chất lỏng là but-1-in và but-2-in người ta dùng thuốc thử nào sau đây: A. dd AgNO3/NH3 B. dd KMnO4 C. dd Br2 D. dd HBr Câu 28: Cho 14gam hỗn hợp gồm 2 anken là đồng đẳng kế tiếp đi qua dung dịch Br2 làm mất màu vừa đủ dung dịch chứa 64g Br2. CTPT của 2 anken là. ( Cho Br = 80) A. C3H6, C4H8 B. C3H6, C5H10 C. C4H8, C5H10 D. C2H4, C3H6 Câu 29: : Cho phản ứng giữa buta-1,3-đien và HBr ở -80oC (tỉ lệ mol 1:1), sản phẩm chính của phản ứng là A. CH3CHBrCH=CH2. B. CH3CH=CHCH2Br. C. CH2BrCH2CH=CH2. D. CH3CH=CBrCH3. Câu 30: Trùng hợp đivinyl tạo ra cao su Buna có cấu tạo là ? A. (-C2H-CH-CH-CH2-)n.B. (-CH2-CH=CH-CH2-)n.C. (-CH2-CH-CH=CH2-)n. D. (-CH2-CH2-CH2-CH2-)n. Câu 31: Một hỗn hợp A gồm 2 hiđrocacbon X, Y liên tiếp nhau trong cùng dãy đồng đẳng. Đốt cháy 11,2 lít hỗn hợp X thu được 57,2 gam CO2 và 23,4 gam CO2. CTPT X, Y và khối lượng của X, Y là: A. 5,6 gam C2H4 và 12,6 gam C3H6. B. 2,8 gam C2H4 và 16,8 gam C3H6. C. 12,6 gam C3H6 và 11,2 gam C4H8. D. 8,6 gam C3H6và 11,2 gam C4H8. Câu 32: Chất nào sau đây phản ứng được với dung dịch AgNO3/NH3: A. buta-1,3-đien B. stiren C. but-2-in D. propin Câu 33: Khi thực hện phản ứng monoclo hóa một ankan ( tỉ lệ mol 1:1) thì chỉ thu 1 sản phẩm thế duy nhất. Tên của ankan đó là: A. Pentan B. Butan C. 2,2- đimetylpropan D. 2,3- đimetylbutan Câu 34: Cho các chất sau: 2-metylbut-1-en (1); 3,3-đimetylbut-1-en (2); 3-metylpent-1-en (3); 3-metylpent-2-en (4); Những chất nào là đồng phân của nhau ? A. (1), (2) và (3). B. (1) và (2). C. (3) và (4). D. (2), (3) và (4). Câu 35: Đốt cháy hai hiđrocacbon là đồng đẳng liên tiếp của nhau ta thu được 6,3 gam nước và 9,68 gam CO2. Công thức phân tử của hai hiđrocacbon đó là A. CH4 và C2H6. B. C2H6 và C3H8. C. C2H4 và C3H6. D. C3H8 và C4H10. Câu 36: Thực hiện phản ứng cộng theo tỉ lệ mol 1:1 giữa 2-metylbuta-1,3-đien với HBr thì có thể thu được tối đa bao nhiêu sản phẩm khác nhau? A. 5 B. 6 C. 3 D. 4 Câu 37: Hợp chất hữu cơ X có tên gọi là: 2 - Clo - 3 - metylpentan. Công thức cấu tạo của X là: A. CH3CH2CH(Cl)CH(CH3)2 B. CH3CH(Cl)CH(CH3)CH2CH3 C. CH3CH2CH(CH3)CH2CH2Cl D. CH3CH(Cl)CH2CH(CH3)CH3 Câu 38: Những hợp chất nào sau đây có đồng phân hình học (cis-trans) ? CH3CH=CH2 (I); CH3CH=CHCl (II); CH3CH=C(CH3)2 (III); C2H5–C(CH3)=C(CH3)–C2H5 (IV); C2H5–C(CH3)=CCl–CH3 (V). A. (II), III, (IV), (V). B. (II), (IV), (V). C. (III), (IV). D. (I), (IV), (V). Câu 39: Hợp chất C5H10 mạch hở có bao nhiêu đồng phân cấu tạo ? A. 5. B. 6. C. 4. D. 10. Câu 40: Chất nào sau đây không làm mất màu dung dịch Br2? A. but-2-en B. propen C. axetilen D. propan Câu 41: Cho iso-pentan tác dụng với Cl2 theo tỉ lệ số mol 1 : 1, số sản phẩm monoclo tối đa thu được là A. 2 B. 3. C. 5. D. 4. Câu 42:khi cho 2-metylbutan tác dụng với Cl2 theo tỷ lệ mol 1:1 thì tạo ra sản phẩm chính là A. 1-clo-2-metylbutan. B. 2-clo-2-metylbutan. C. 2-clo-3-metylbutan. D. 1-clo-3-metylbutan.
CHƯƠNG 7 :HIDRO CACBON THƠM -NGUỒN HIDROCACBON THIÊN NHIÊN A. KIẾN THỨC CẦN NẮM VỮNG BENZEN VÀ DÃY ĐỒNG DẲNG - Định nghĩa , cấu trúc phân tử , đồng đẳng, đồng phân và danh pháp, t/chất vật lý, t/chất hóa học. B. MỘT SỐ CÂU HỎI VÀ BÀI TẬP THAM KHẢO 1. Viết CTCT và gọi tên các hidrocacbon thơm có CTPT C8H10 , C9H12 2. Viết các PTHH xảy ra (ghi rõ điều kiện phản ứng ) khi cho: benzen, toluen lần lượt tác dụng với Br2, HNO3 theo tỉ lệ 1:1. 3. Viết PTHH: stiren lần lượt tác dụng với nước brom, H2, trùng hợp 4. Bằng phương pháp hóa học, phân biệt các chất lỏng sau: a. Benzen, stiren , toluen b. Benzen , etylbenzen , hex-1-en 5. Cho benzen tác dụng với brom theo tỉ lệ mol 1:1 ( Fe xúc tác ) thu được sản phẩm gồm chất lỏng B và khí C. Hấp thụ C vào 2 lít dd NaOH 0,5M .Để trung hoà NaOH dư, cần 0,5 lít dd HCl 1M. Tính khối lượng bezen phản ứng và khối lượng chất B? 6. Hidrocacbon X là đồng đẳng của benzen có % khối lượng C bằng 90,56% . Hãy xác định CTPT của X? TRẮC NGHIỆM Câu 1. Công thức tổng quát dãy đồng đẳng của benzen là A. CnH2n+1( n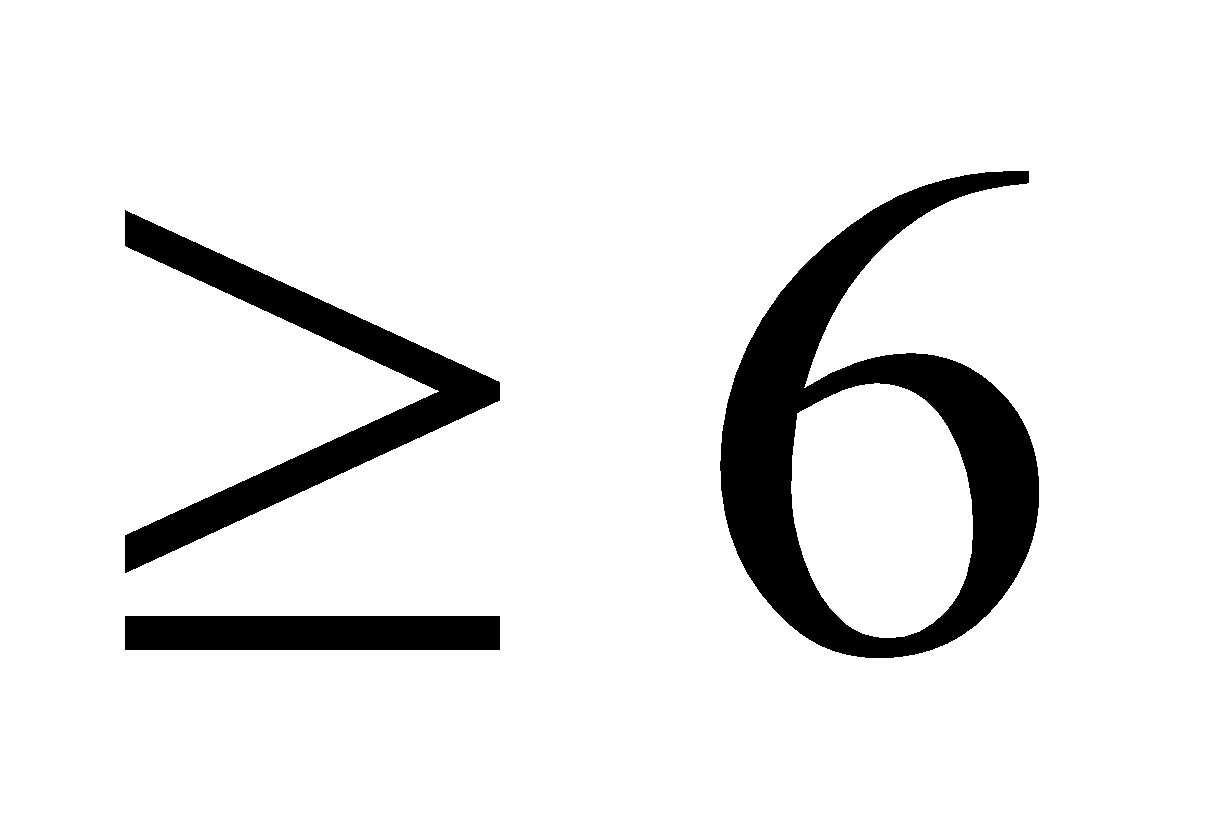 ) B. CnH2n+2( n ) B. CnH2n+2( n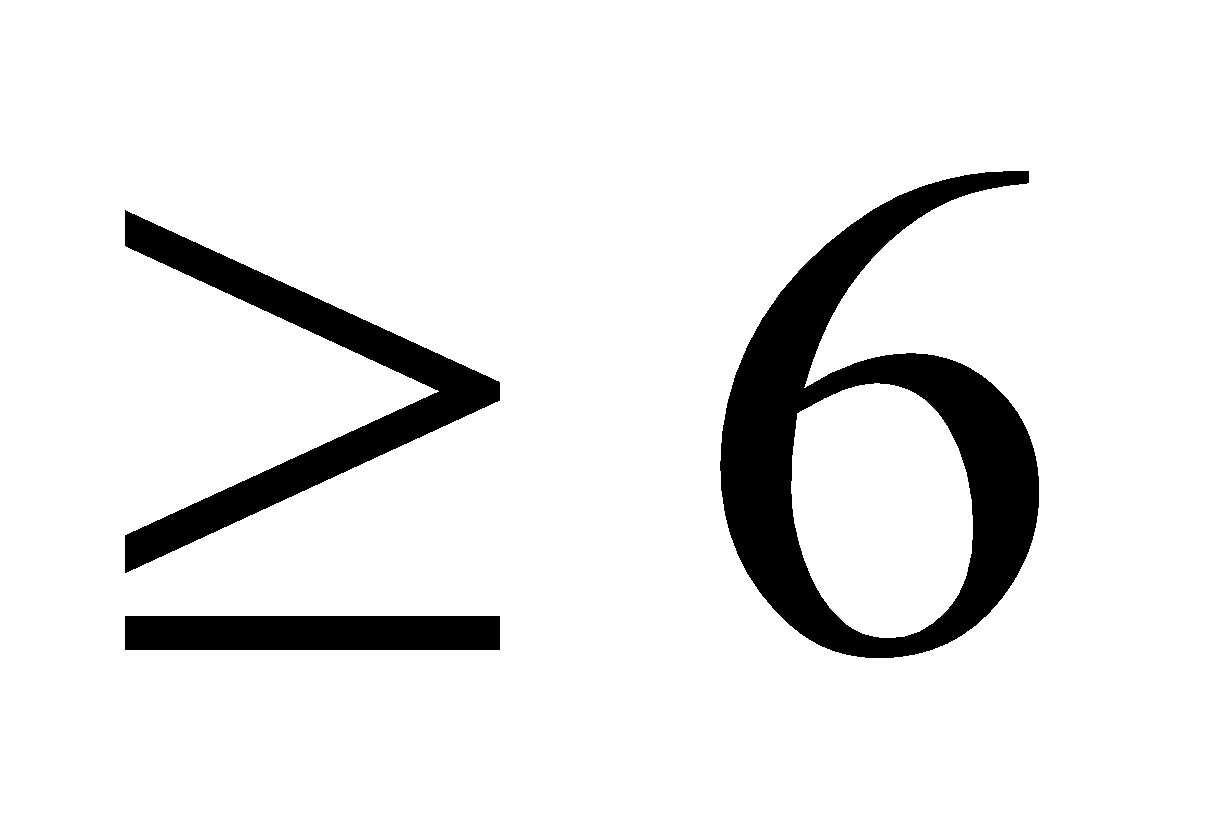 ) C. CnH2n-6( n ) C. CnH2n-6( n ) D. CnH2n( n ) D. CnH2n( n ) ) Câu 2. Chất nào sau đây thuộc dãy đồng đẳng của benzen? A. C6H5CH3 B. C6H11CH3 C. C6H11CH2CH3 D. C6H5OH
Câu 3. Tính thơm của benzen và dãy đồng đẳng của benzen thể hiện là A. Dễ tham gia phản ứng cộng, khó tham gia phản ứng thế B. Dễ tham gia phản ứng cộng, khó tham gia phản ứng oxi hóa C. Dễ tham gia phản ứng thế, khó tham gia phản ứng cộng, bền vững với chất oxi hóa D. Dễ tham gia phản ứng với chất oxi hóa, halogen ở nhiệt độ thường Câu 4. ở điều kiện thích hợp, benzen tácdụng được với tất cả các chất trong nhóm nào sau đây ? A. brom khan, khí Clo, dd thuốc tím , hidro B. brom khan, khí clo, hỗn hợp HNO3đ và H2SO4đ, hidro C. hỗn hợp HNO3 đ và H2SO4đ, KMnO4, hidro D. dd brom, hỗn hợp HNO3đ và H2SO4đ, hidro Câu 5. Ở điều kiện thích hợp, toluen tác dụng được với tất cả các chất trong nhóm nào sau đây ? A. ddbrom , dd thuốc tím, hidro, oxi B. brom khan, hỗn hợp HNO3đặc và H2SO4đ, oxi, hidro, ddKMnO4 C. hỗn hợp HNO3đặc và H2SO4đ, KMnO4,hidro, oxi, nước Clo D. ddBrom, hỗn hợp HNO3đặc và H2SO4đ, oxi, ddKMnO4 Câu 6. Toluen phản ứng thế ở nhân benzen với các chất tương tự benzen nhưng khác với benzen A. phản ứng của toluen xảy ra chậm hơn và chỉ có một sản phẩm duy nhất B. phản ứng của toluen xảy ra chậm hơn và thường có 2 sản phẩm C. phản ứng của toluen xảy ra dễ dàng hơn và thường có 2 sản phẩm thế vào vị trí ortho và para D. phản ứng của toluen xảy ra nhanh hơn và chỉ có một sản phẩm duy nhất Câu 7. Nhóm sản phẩm nào sau đây là của phản ứng giữa toluen với brom khan có bột sắt làm xúc tác? 1. o-bromtoluen 2. p-bromtoluen 3. benzyl bromua 4. etylbrombenzen A. 1,3 B. 2,3 C.1,4 D. 1,2 Câu 8. Có thể dùng chất nào sau đây để phân biệt 2 chất lỏng là benzen và toluen? A. brom khan và bột sắt B. dd brom C. hỗn hợp HNO3 đặc và H2SO4đ D. dd thuốc tím, đun nóng Câu 9. Cho 0,78g benzen vào ống nghiệm chứa sẵn hỗn hợp HNO3đặc và H2SO4đặc dư và lắc mạnh thu được một chất lỏng nặng màu vàng nhạt. Khối lượng chất lỏng đó là A. 12,3g B. 6,15g C. 1,23g D. 0,123g Câu 10. Khi đốt cháy hoàn toàn hiđrocacbon lỏng X thu được tỉ lệ thể tích V CO2: VH2O = 2:1. CTPT của X là A. C5H12 B. C5H10 C. C6H6 D. C2H2 Câu 11. Kết luận nào sau đây không đúng ? A. stiren không làm mất màu dd thuốc tím B. Stiren còn có tên là vinylbenzen C. các nguyên tử trong phân tử stiren cùng nằm trên một mặt phẳng D. Stiren vừa có tính chất giống anken vừa có tính chất giống bezen Câu 12. Tính chất hóa học của stiren là A. làm mất màu dd brom B. làm mất màu dd thuốc tím C. có phản ứng trùng hợp , đồng trùng hợp D. tất cả A,B,C đều đúng Câu 13. Khi cho hợp chất hữu cơ X vào dd brom thì thấy dd brom nhạt màu, tạo thành hợp chất C8H8 Br2. Chất X là A. C6H5CH2CH=CH2 B. C6H5C2H5 C. C6H5CH=CH2 D. C6H5CH3 Câu 14. Cho sơ đồ điều chế polistiren như sau: Khí thiên nhiên  C2H2 C2H2  X X  C6H5C2H5 C6H5C2H5 Y Y PS. X,Y tương ứng là PS. X,Y tương ứng là A. C6H6 và C7H8 B. C6H6 và C8H8 C. C2H4 và C8H8 D. C4H6 và C8H10 Câu 15. Phản ứng hóa học nào sau đây xảy ra trong quá trình cracking? A. C4H10  C2H6 + C2H4 C2H6 + C2H4 B. CH3-[CH2]4–CH3  CH3-CH(CH3) CH2CH2CH=CH2 CH3-CH(CH3) CH2CH2CH=CH2 C. CH3-[CH2]4–CH3 xiclohexan +H2 xiclohexan +H2 D. Xiclohexan  benzen + 3H2 benzen + 3H2
ANCOL - PHENOL Câu 1: Ancol no, đơn chức, mạch hở có công thức chung là A. CnH2n - 1OH (n≥3). B. CnH2n +1CHO (n≥0). C. CnH2n + 1COOH (n≥0). D. CnH2n + 1OH (n≥1). Câu 2: Bậc của ancol là A. bậc cacbon lớn nhất trong phân tử. B. bậc của cacbon liên kết với nhóm -OH. C. số nhóm chức có trong phân tử. D. số cacbon có trong phân tử ancol. Câu 3: Có bao nhiêu đồng phân ancol có công thức phân tử là C4H10O ? A. 6. B. 7. C. 4. D. 5. Câu 4: Số đồng phân ancol ứng với CTPT C5H12O là A. 8. B. 7. C. 5. D. 6. Câu 5: Dãy gồm các chất đều phản ứng được với C2H5OH là A. Na, Fe, HBr. B. CuO, KOH, HBr. C. NaOH, Na, HBr. D. Na, HBr, CuO. Câu 6: Khi lên men 180 gam glucozơ với hiệu suất 80%, khối lượng ancol etylic thu được là A. 147,2 gam. B. 276 gam. C. 92 gam. D. 184 gam. Câu 7: Khi oxi hóa 6,9 gam ancol etylic bởi CuO, t o thu được lượng andehit axetic với hiệu suất 80 % là : A. 6,6g B. 8,25g C. 5,28g D. 3,68g Câu 8: ancol etylic tan trong nước vì : Phản ứng với nước. B. Tạo được liên kết hidro với nước.
C. Điện li thành ion. D. Cho được liên kết hidro với ancol . Câu 9: Số lượng các đồng phân ancol có công thức phân tử C5H12O là : A. 6. B. 7. C. 8. D. 9 Câu 10: Ancol đơn no chúa 6 nguyên tử cacbon có số lượng đồng phân ancol bậc một là : A. 5 B. 6 C. 7 D. 8 Câu 11: Phản ứng nào sau đây không xảy ra : C2H5OH + HBr B. C2H5OH + NaOH. C. C2H5OH + Na D.C2H5OH + CuO
Câu 12: Đốt cháy hoàn toàn m gam ancol no đơn chức mạch hở, sau phản ứng thu được 4,48 lít CO2 (đktc) và 5,4 gam nước. Công thức của ancol là: A. C2H5OH B. C3H7OH C. CH3OH D. C4H9OH Câu 13: Đun nóng ancol etylic với axit sufuric đặc ở 1400C, thu được sản phẩm chính là: A. C2H6 B. C2H4 C. (CH3)2O D. (C2H5)2O Câu 14 : Khi đun nóng ancol etylic với H2SO4 đặc ở 1700C thì sẽ tạo ra sản phẩm chính là A. CH3COOH. B. CH3CHO. C. C2H4. D. C2H5OC2H5 Câu 15: Cho 3,5 gam hỗn hợp 2 ancol đơn chức tác dụng với Na vừa đủ thu được 1,12 lít H2 ở đktc. Sau phản ứng cô cạn thu được m gam muối. Giá trị m là : A. 5,7 gam B. 6,2 gam C. 7,5 gam D. 4,2 gam Câu 16: Thuốc thử dùng để phân biệt etanol và phenol là A. dung dịch NaOH B. dung dịch brom C. Cu(OH)2 D. A và B đều đúng Câu 17: Oxi hóa rượu bằng CuO đun nóng thu được xeton, thì rượu đó là rượu bậc : 1 B. 2 C.3 D. Cả A, B, C đúng
Câu 18: Đốt cháy một ancol đơn chức, mạch hở X thu được CO2 và hơi nước theo tỉ lệ thể tích  . CTPT của X là . CTPT của X là A. C4H10O. B. C3H6O. C. C5H12O. D. C2H6O. Câu 19: Đun nóng hỗn hợp X gồm 0,1 mol CH3OH và 0,2 mol C2H5OH với H2SO4 đặc ở 140oC, khối lượng ete thu được là A. 12,4 gam. B. 7 gam. C. 9,7 gam. D. 15,1 gam. Câu 20: Đốt cháy hoàn toàn m gam ancol đơn chức A được 6,6 gam CO2 và 3,6 gam H2O. Giá trị m là A. 10,2 gam. B. 2 gam. C. 2,8 gam. D. 3 gam. Câu 21: Đề hiđrat hóa 14,8 gam ancol thu được 11,2 gam anken. CTPT của ancol là A. C2H5OH. B. C3H7OH. C. C4H9OH. D. CnH2n + 1OH. Câu 22: Cho 7,6 gam một ancol no, đơn chức tác dụng với Na vừa đủ. Sau phản ứng thu được V lít khí H2 và cô cạn được 10,9 gam muối. Giá trị của V là A. 1,68 B. 2,24 C. 3,36 D. 2,8 Câu 23: Một ancol no đơn chức có %H = 13,04% về khối lượng. CTPT của ancol là A. C6H5CH2OH. B. CH3OH. C. C2H5OH. D. CH2=CHCH2OH Câu 24: Đốt cháy hoàn toàn m gam ancol no đơn chức mạch hở, sau phản ứng thu được 4,48 lít CO2 (đktc) và 5,4 gam nước. Công thức của ancol là: A. C2H5OH B. C3H7OH C. CH3OH D. C4H9OH Câu 25: Cho 4,6 gam ancol etylic phản ứng hoàn toàn với Na (dư) thu được V lít khí H2 (đktc). Giá trị của V là: (C = 12, H = 1, O = 16) A. 2,24 B. 4,48 C. 3,36 D. 1,12 Câu 26: Cho 4,6 gam ancol etylic phản ứng hoàn toàn với Na (dư) thu được V lít khí H2 (đktc). Giá trị của V là: (C = 12, H = 1, O = 16) A. 2,24 B. 4,48 C. 3,36 D. 1,12 Câu 27: Cho 6,4 gam ancol metylic phản ứng hoàn toàn với Na (dư) thu được V lít khí H2 (ở đktc). Giá trị của V là A. 2,24. B. 1,12. C. 4,48. D. 3,36. Câu 28: Cho 3,70 gam một ancol X no, đơn chức, mạch hở tác dụng với natri vừa đủ thấy có 0,56 lít khí thoát ra (ở đktc). Sau phản ứng cô cạn thu được m g muối, giá trị của m là: A. 4,2 B. 4,8 C. 5,2 D. 6 Câu 29: Đốt cháy hoàn toàn 6g một ancol no, đơn, hở X thu được 13,2g CO2. CTPT của X là A. CH3OH B. C2H5OH C. C3H7OH. D. C4H9OH Câu 30: Cho m gam glucozơ C6H12O6 lên men thành rượu etylic với H=80%. Hấp thu toàn bộ khí CO2 vào dd nước vôi trong dư thu 20 g kết tủa .giá trị của m là A. 45. B. 11,25. C. 14,4. D. 22,5. PHENOL Câu 31: Phát biểu nào sau đây sai A. Phênol là axit yếu ,nhưng tính axit vẫn mạnh hơn axit cacboxylic B. Phênol là một axit yếu, không làm đổi màu quỳ tím C. Phênol cho kết tủa trắng với dd nước brôm D. Phênol rất ít tan trong nước lạnh Câu 32: Chất thơm không td với dd NaOH là A. C6H5CH2OH B. p-CH3C6H4OH C. C6H5OH D. C6H5NH3Cl Câu 33: Để điều chế natriphenolat thì cho phenol tác dụng với A. Na. B. NaOH. C. NaHCO3. D. Na hoặc NaOH. Câu 34: Phenol (C6H5OH) tác dụng được với: A. CH4. B. NaCl. C. NaOH. D. NaNO3. Câu 35: Chọn câu đúng: “Phenol có thể tác dụng với …” A. HCl và Na B. Na và NaOH. C. NaOH và HCl. D. Na và Na2CO3. Câu 36: Hóa chất duy nhất dùng để nhận biết 3 chất lỏng đựng riêng biệt trong ba bình mất nhãn: phenol, stiren và rượu etylic là... A. natri kim loại. B. quỳ tím. C. dung dịch naOH. D. dung dịch brom Câu 37: Hãy chọn câu đúng khi so sánh tính chất hóa học khác nhau giữa ancol etylic và phenol . cả hai đều phản ứng được với dung dịch NaOH. Cả hai đều phản ứng được với axit HBr. Ancol etylic phản ứng được với NaOH còn phenol thì không. Phenol phản ứng với dung dịch NaOH còn ancol etylic thì không.
Câu 38: Phát biểu nào sau đây sai : Phenol là axit yếu, không làm đổi màu quỳ tím. Phenol là axit yếu, nhưng tính axit vẫn mạnh hơn axit cacbonic. Phenol cho kết tủa trắng với dung dịch nước brom. Phenol rất ít tan trong nước lạnh
Câu 39: Cho các phát biểu sau: (1) Phenol C6H5-OH là một rựơu thơm. (2) Phenol tham gia phản ứng thế brom và thế nitro NO2 dễ hơn benzen. (3) Phenol tác dụng được với natri hidroxit tạo thành muối và nước. (4) Trong phân tử phenol có sự ảnh hưởng qua lại giữa nhóm –OH và vòng benzen. Số phát biểu đúng làA. 1. B. 2. C. 3. D. 4. Câu 40: Khi cho Phenol tác dụng với nước brom, ta thấy: mất màu nâu đỏ của nước brom. B. tạo kết tủa đỏ gạch.
C. tạo kết tủa trắng. D. tạo kết tủa xám bạc. Câu 41: Dãy gồm các chất đều phản ứng với phenol là A. dung dịch NaCl, dung dịch NaOH, kim loại Na.B. nước brom, axit axetic, dung dịch NaOH. C. nước brom, HNO3, dung dịch NaOH. D. nước brom, anđehit axetic, dung dịch NaOH. Câu 42: Cho lần lượt các chất C3H5(OH)3, C2H5OH, C6H5OH pư với Cu(OH)2. Hỏi mấy chất không phản ứng? A. Không chất nào. B. Một chất. C. Hai chất D. Cả 3 chất. Câu 43: Nhúng quỳ tím vào ống nghiệm đựng phenol, thấy: A. Quỳ tím hóa đỏ B. Quỳ tím hóa xanh C. Quỳ tím không đổi màu D. Quỳ tím hóa thành màu hồng Câu 44: Trong các chất sau ,chất nào có nhiệt độ sôi cao nhất A. phenol B. etanol C. đimetyl ete D. metanol Câu 45: Cho các chất sau: phenol, etanol và glixerol. kết luận nào sau đây là đúng? A. có một chất td được với Na B. có hai chất td được với dd NaOH C. cả ba chất đều td được với dd Na2CO3 D. cả ba chất đều tan tốt trong nước Câu 46: Ảnh hưởng của nhóm -OH đến gốc C6H5- trong phân tử phenol thể hiện qua phản ứng giữa phenol với A. dung dịch NaOH. B. Na kim loại. C. nước Br2. D. H2 (Ni, t0C). Câu 47: Cho các hợp chất sau : (a) HOCH2CH2OH. (b) HOCH2CH2CH2OH. (c) HOCH2CH(OH)CH2OH. (d) CH3CH(OH)CH2OH. (e) CH3CH2OH. (f) CH3OCH2CH3. Các chất đều tác dụng được với Na, Cu(OH)2 là A. (a), (b), (c). B. (c), (d), (f). C. (a), (c), (d). D. (c), (d), (e). Câu 48: Trong các chất dưới đây, chất nào là ancol A. C6H5OH B. CH3COOH C. C6H5CH2OH D. CH3CH2OCH3 Câu 49: Tên quốc tế của hợp chất có công thức CH3CH(C2H5)CH(OH)CH3 là A. 4-etyl pentan-2-ol. B. 2-etyl butan-3-ol. C. 3-etyl hexan-5-ol. D. 3-metyl pentan-2-ol. Câu 50: Cho ancol có CTCT: CH3-CH(CH3)-CH2-CH2-CH2-OH. Tên nào dưới đây ứng với ancol trên A. 2-metylpentan-1-ol B. 4-metylpentan-1-ol C. 4-metylpentan-2-ol D. 3-metylhexan-2-ol Câu 51: Các ancol (CH3)2CHOH ; CH3CH2OH ; (CH3)3COH có bậc ancol lần lượt là A. 1, 2, 3. B. 1, 3, 2. C. 2, 1, 3. D. 2, 3, 1. Câu 52: Cho m gam phenol tác dụng với natri dư thấy thoát ra 5,6 lít khí H2 (đktc). Giá trị m là A. 47. B. 23,5. C. 47,5. D. 23,75. Câu 53: Cho nước brom dư vào dung dịch chứa m gam phenol thu được 6,62 gam kết tủa trắng (phản ứng hoàn toàn). Giá trị m làA. 1,88. B. 8,18. C. 8,81. D. 18,8. Câu 54: Cho 1,88 gam phenol tác dụng vừa đủ với V ml dung dịch NaOH 1M. Giá trị của V là: A. 30 ml B. 10 ml C. 20 ml D. 40 ml
|