ĐỀ THAM KHẢO HÓA 12
ĐỀ THAM KHẢO KIỂM TRA HỌC KỲ 2
Môn: Hoá học - Lớp 12
Thời gian: 45 phút
ĐỀ THAM KHẢO SỐ 1
I–Trắc nghiệm
Câu 1. Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là:
A. ns2np3 B. ns2np4 C. ns2np5 D. ns2np6
Câu 2. Chất X là chất khí ở điều kiện thường, có màu vàng lục, dùng để khử trùng nước sinh hoạt… Chất X là: A. O2 B. Cl2 C. SO2 D. O3
Câu 3. Cho 15,8 gam KMnO4 tác dụng hoàn toàn với HCl đặc, dư. Thể tích khí thu được ở (đktc) là:
A. 5,6 lít B.3,36 lít C. 2,24 lít D. 1,12 lít
Câu 4. Cho lần lượt các chất sau: Cu, C, MgO, KBr, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3 tác dụng với dung dịch H2SO4 đặc, nóng. Số phản ứng oxi hoá - khử là:
A. 9 B. 8 C. 7 D. 6
Câu 5. Thuốc thử có thể dùng để phân biệt được cả 4 lọ KF, KCl, KBr, KI là
A. AgNO3 B. NaOH C. quỳ tím D. Cu
Câu 6. Có 3 bình đựng 3 chất khí riêng biệt: O2, O3, H2S lần lượt cho từng khí này qua dung dịch KI có pha thêm hồ tinh bột, chất khí làm dung dịch chuyển màu xanh là :
A. O2 B. H2S C. O3 D. O3 và O2
Câu 7. Có 4 dd sau đây: HCl , Na2SO4 , NaCl , Ba(OH)2 . Chỉ dùng thêm 1 hóa chất nào sau đây để phân biệt được 4 chất trên?
A. Na2SO4. B. Phenolphtalein. C. dd AgNO3 . D. Quỳ tím
Câu 8. Cu kim loại có thể tác dụng với chất nào trong các chất sau?
A. Khí Cl2. B. Dung dịch HCl. C. Dung dịch KOH đặc D. Dung dịch H2SO4 loãng.
Câu 9. Dẫn khí clo qua dung dịch NaOH ở nhiệt độ phòng, muối thu được là:
A. NaCl, NaClO3 B. NaCl, NaClO C. NaCl, NaClO4 D. NaClO, NaClO3
Câu 10. Dãy chất nào sau đây vừa có tính oxi hoá, vừa có tính khử?
A. O2 , Cl2 , H2S. B. S, SO2 , Cl2 C. F2, S , SO3 D. Cl2 , SO2¬, H2SO4
Câu 11. Dãy chất tác dụng được với dung dịch H2SO4 đặc nguội là:
A. CaCO3, Al, CuO B. Cu, MgO, Fe(OH)3 C. S, Fe, KOH D. CaCO3, Au, NaOH
Câu 12. Dung dịch axit HCl tác dụng được với dãy chất nào sau đây:
A. Zn, CuO, S. B. Fe, Au, MgO C. CuO, Mg, CaCO3 D. CaO, Ag, Fe(OH)2
Câu 13. Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng:
A. Xuất hiện chất rắn màu đen B. Chuyển sang màu nâu đỏ
C. Vẫn trong suốt, không màu D. Bị vẩn đục, màu vàng.
Câu 14. Hấp thụ 6,72 lít khí SO2 (đktc) vào 250 ml dung dịch NaOH 2M. Dung dịch sau phản ứng chứa:
A. NaHSO3 1,2M. B. Na2SO3 1M .
C. NaHSO3 0,4M và Na2SO3, 0,8M. D. NaHSO3 0,5M và Na2SO3, 1M.
Câu 15. Hòa tan 10,8 gam một kim loại R có hóa trị không đổi vào dung dịch HCl loãng dư thu được 10,08 lít H2 (ở đktc). Kim loại R là:
A. Mg B. Fe C. Zn D. Al
Câu 16. Hòa tan hết m gam hỗn hợp CuO, MgO, Fe2O3 vào 400 ml dung dịch axit HCl 3M vừa đủ. Cô cạn dung dịch sau phản ứng thu được 65 gam muối khan. Tính m?
A. 22,4 g B. 32,0 g C. 21,2 g D. 30,2 g
Câu 17. Oxi hóa 16,8 gam sắt bằng V lít không khí (ở đktc) thu được m gam chất rắn A gồm (Fe, FeO, Fe2O3, Fe3O4). Hòa tan hết A bằng dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 sản phẩm khử duy nhất. Tính V (Biết các khí đo ở đktc và O2 chiếm 1/5 thể tích không khí).
A. 33,6 lit B. 11,2 lít C. 2,24 lít D. 44,8 lít
Câu 18. Phương pháp để điều chế khí O2 trong phòng thí nghiệm là:
A. Điện phân H2O B. Chưng cất phân đoạn không khí lỏng
C. Nhiệt phân KMnO4 D. Điện phân dung dịch NaCl
Câu 19. Thuốc thử để phân biệt 2 bình đựng khí H2S, O2 là:
A. Dd HCl B. Dd KOH C. Dd NaCl D. Dd Pb(NO3)2
Câu 20. Trộn 100 ml dung dịch H2SO4 2M và 208g dung dịch BaCl2 15% thì khối lượng kết tủa thu được là:
A. 58,25g B. 23,30g C. 46,60g D. 34,95g.
ĐỀ THAM KHẢO SỐ 2
Câu 1: Muốn pha loãng dung dịch axit H2SO4 đặc cần phải:
A. Rót từ từ nước vào dung dịch axit đặc. B. Rót từ từ dung dịch axit đặc vào nước
C. Rót nhanh dung dịch axit vào nước D. Rót nước thật nhanh vào dung dịch axit đặc
Câu 2: Cho các yếu tố sau:
a. áp suất b. xúc tác c. nồng độ chất. d. nhiệt độ e. diện tích tiếp xúc.
Những yếu tố ảnh hưởng đến tốc độ phản ứng nói chung là:
A.a, b, c, d. B. b, c, d, e. C. a, c, e. D. a, b, c, d, e.
Câu 3: Trong phòng thí nghiệm, người ta thường điều chế khí Clo bằng cách:
A. Điện phân dung dịch NaCl có màng ngăn B. Điện phân nóng chảy NaCl
C. Cho F2 đẩy Cl2 khỏi dung dịch NaCl D. Cho dung dịch HCl đặc tác dụng với MnO2
Câu 4: Lưu huỳnh có các mức oxi hóa là
A. -2, 0, +4, +6 B. -1; 0; +1; +3; +5; +7 C. +1; +3; +5; +7 D. -2; 0; +6; +7
Câu 5: Cho phản ứng hóa học SO2 + Br2 + H2O → HBr + H2SO4. Hệ số cân bằng của phản ứng trên lần lượt là?A. 2,1,2,1,2 B. 2,2,1,1,2 C. 1,1,2,2,1 D. 1,2,1,2,1
Câu 6: Thuốc thử có thể dùng để phân biệt được cả 4 lọ KF, KCl, KBr, KI là
A. AgNO3 B. NaOH C. quỳ tím D. Cu
Câu 7: Nước Gia-ven được điều chế bằng cách
A. Cho clo tác dụng với nước B. Cho clo sục vào dung dịch NaOH
C. Cho clo sục vào dung dịch KOH đặc nóng D. Cho clo tác dụng với Ca(OH)2
Câu 8: Nước clo hoặc khí clo ẩm có tính tẩy màu (tẩy trắng) vì nguyên nhân là :
A. Clo hấp thụ màu B. Nước clo chứa HClO có tính oxi hóa mạnh, tẩy màu
C. Clo tác dụng với nước tạo ra HCl có tính tẩy màu D. Tất cả đều đúng
Câu 9: Để phân biệt được 3 chất khí : CO2, SO2 và O2 đựng trong 3 bình mất nhãn riêng biệt , người ta dùng thuốc thử là:
A. Dung dịch Br2 B. Nước vôi trong (dd Ca(OH)2) và dung dịch Br2
C. Nước vôi trong (dd Ca(OH)2) D. Dung dịch KMnO4
Câu 10: Cho 16,25 gam một kim loại M hoá trị II tác dụng vừa đủ với 250ml dung dịch HCl 2M. Kim loại M là:A. Al B. Cu C. Zn D. Mg
Câu 11: Kim loại nào dưới đây có phản ứng với axit H2SO4 đặc, nguội?
A. Fe B. Al C. Zn D. Cr
Câu 12: Cho các chất: O2, S, SO2, H2S, H2SO4. Có bao nhiêu chất vừa có tính oxi hóa, vừa có tính khử?
A. 4. B. 2. C. 1. D. 3.
Câu 13: Đổ dung dịch chứa 1 gam HCl vào dung dịch chứa 1 gam NaOH. Nhúng quỳ tím vào dung dịch thu được thì quỳ tím chuyển sang màu nào?
A. Màu xanh B. Màu đỏ C. Màu tím D. Màu vàng
Câu 14: Cấu hình electron lớp ngoài cùng của lưu huỳnh là :
A. 3s23p4 B. 3s23p6 C. 3s23p3 D. 2s22p4
Câu 15: Tầng ozon có khả năng ngăn tia cực tím từ vũ trụ thâm nhập vào trái đất vì
A. Tầng ozon có khả năng phản xạ ánh sáng tím.
B. Tầng ozon đã hấp thụ tia cực tím cho cân bằng chuyển hóa ozon và oxi.
C. Tầng ozon rất dày, ngăn không cho tia cực tím đi qua.
D. Tầng ozon chứa khí CFC có tác dụng hấp thụ tia cực tím.
Câu 16: Cho hệ cân bằng sau được thực hiện trong bình kín : 2SO2(k) + O2(k) 2SO3 (k), H < 0
Yếu tố nào sau đây giúp làm tăng hiệu suất tổng hợp SO3?
A. Giảm nhiệt độ, tăng áp suất B. Tăng nhiệt độ, giảm áp suất
C. Tăng nhiệt độ, tăng áp suất D. Giảm nhiệt độ, giảm áp suất
Câu 17: Cho các phương trình hóa học sau:
(1) F2 + H2O → HF + HFO (2) 2KBr + I2 → 2KI + Br2
(3) NaF + AgNO3 → AgF + NaNO3 (4) Cl2+ 2FeCl2→ 2FeCl3
Số phương trình hóa học không đúng là: A. 4 B. 3 C. 2 D. 1
Câu 18: Cho 2,8 g 1 kim loại R bằng H2SO4 đặc nóng thu được 1,68 lít khí SO2 (đktc) sản phẩm khử duy nhất. R là:A. Cu B. Al C. Fe D. Ag
Câu 19: Kim loại Cu không phản ứng được với chất nào sau đây:
A. H2SO4 loãng B. H2SO4 đặc C. O2 D. Cl2
Câu 20: Trong các chất sau, chất nào chỉ có tính khử?
A. S. B. SO2. C. H2S. D. H2SO4.
ĐỀ THAM KHẢO SỐ 3
Câu 1: Dẫn khí X đến dư qua dung dịch brom, thấy dung dịch brom bị mất màu. Khí X có thể là
A. SO3. B. CO2. C. SO2. D. Cl2.
Câu 2: Hấp thụ hoàn toàn 2,24 lit khí SO2 (đktc) vào dung dịch chứa 0,2 mol NaOH. Sau phản ứng thu được dung dịch chứa muối
A. NaHSO3. B. Na2S. C. Na2SO3. D. Na2SO4.
Câu 3: Nhiệt phân hoàn toàn 30,02 gam KMnO4 với hiệu suất là 75%, thể tích O2 (đktc) thu được là
A. 2,128 lít. B. 2,837 lít. C. 1,596 lít. D. 2,576 lít.
Câu 4: Cho m gam Cu tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng (dư) thu được 6,72 lít khí SO2 (ở đktc, sản phẩm khử duy nhất). Giá trị của m là
A. 9,6. B. 4,8. C. 1,92. D. 19,2.
Câu 5: Một mẫu khí thải công nghiệp có nhiễm các khí H2S, CO, CO2. Để nhận biết sự có mặt của H2S trong mẫu khí thải đó, ta dùng dung dịch
A. NaOH. B. Pb(NO3)2. C. Ca(OH)2. D. NaNO3.
Câu 6: Cho 20 gam hỗn hợp KHCO3 và CaCO3 vào dung dịch HCl dư, sau khi phản ứng hoàn toàn thu được V lit khí (đktc). Giá trị của V là
A. 4,48. B. 1,12. C. 2,24. D. 3,36.
Câu 7: Hòa tan hoàn toàn 14,40 gam kim loại M (hóa trị II) trong dung dịch HCl loãng (dư) thu được 13,44 lít khí H2 (đktc). Kim loại M làA. Mg. B. Ca. C. Ba. D. F.
Câu 8: Hòa tan hoàn toàn 6,1 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 2,24 lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 31,80. B. 31,40. C. 15,7. D. 8,98.
Câu 9: Dùng bông tẩm dung dịch axit sunfuric rồi viết lên tờ giấy trắng, sau đó hơ nóng trên ngọn lửa đèn cồn thì thấy nét chữ xuất hiện màu đen do dung dịch axit sunfuric đặc có tính háo nước. Axit sunfuric có công thức phân tử làA. HCl. B. H2S. C. Na2SO4. D. H2SO4.
Câu 10: Kim loại nào sau đây phản ứng được với dung dịch H2SO4 đặc nguội?
A. Au. B. Cu. C. Fe. D. Al.
Câu 11: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là:
A. Ag,Mg,Pb,Fe. B. Cu,Zn,Au,Pt C. Cu,Zn,Ca,Al D. Mg,Na,Fe,Al
Câu 12: Phản ứng nào không xảy ra được giữa các cặp chất sau?
A. Ba(NO3)2 và Na2SO4B. AgNO3 và NaCl C. Cu(NO3)2 và NaOH D. KNO3 và NaCl
Câu 13: Phản ứng tổng hợp NH3 theo phương trình hóa học N2 + 3 H2 2NH3 ; .
Để cân bằng chuyển dời theo chiều thuận cần:
A. giảm nhiệt độ B. A và C C. tăng nhiệt độ D. tăng áp suất
Câu 14: Cho 14.7g axit sunfuric loãng tác dụng với Fe dư. Tính thể tích khí bay ra vào cho biết tên chất khí.
A. 1,68 lít H¬2 B. 3,36 lít H2 C. 3,36 lít SO2 D. 1,68 lít SO2
Câu 15: Cho 15,8 gam KMnO4 tác dụng hoàn toàn với HCl đặc, dư. Thể tích khí thu được ở (đktc) là:
A. 3,36 lít B. 1,12 lít C. 5,6 lít D. 2,24 lít
Câu 16: Tính oxi hoá của các halogen được sắp xếp như sau:
A. Cl2 > F2 > Br2 > I2 B. I2> Br2 >Cl2 > F2 C. F2 >Cl2 > Br2 > I2 D. Br2 > F2> I2 >Cl2
Câu 17: Đặc điểm chung của các nguyên tố halogen là:
A. vừa có tính oxi hóa, vừa có tính khử B. có tính oxi hóa mạnh
C. Ở điều kiện thường là chất khí D. tác dụng mạnh với nước
Câu 18: Hơi thủy ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là:A. Cát B. Muối ăn C. Lưu huỳnh D. Vôi sống
Câu 19: Cho 16 gam hỗn hợp bột Fe và Mg tác dụng với dung dịch HCl dư thấy có 1 gam khí H2 bay ra. Khối luợng muối tạo ra trong dung dịch là:
A. 51,5 gam. B. 33,75 gam. C. 87 gam. D. 52,5 gam.
Câu 20: Cho 18,2 gam hỗn hợp 2 kim loại Cu và Al vào dung dịch HCl thu được 6,72 lít khí H2 (đktc), dung dịch X và chất rắn không tan B. Cho B phản ứng với H2SO4 đặc thu 4,48 lít khí SO2 (đktc). Khối lượng mỗi kim loại trong hỗn hợp ban đầu lần lượt là:
A. 12,8 gam Cu và 11,8 gam Al B. 6,4 gam Cu và 5,4 gam Al
C. 6,4 gam Cu và 11,8 gam Al D. 12,8 gam Cu và 5,4 gam Al
B. BÀI TẬP TỰ LUẬN
Câu 1: Thực hiện các dãy chuyển hóa sau, ghi rõ điều kiện phản ứng (nếu có):
a) NaCl → Cl2 → HCl → NaCl → HCl → Cl2 → Br2 → I2 → AlI3
b)FeS2 SO2 S SO2 SO3 H2SO4 FeSO4 FeCl3 Fe(NO3¬)3
c) KClO3 O2 SO2 H2SO4 CuSO4 Fe2(SO4)3 BaSO4
Câu 2: Nêu hiện tượng và viết ptpư khi:
a) Cho dd Na2¬S vào dd Pb(NO3)2. b) Để lâu lọ chứa dd H2S mở nắp lâu ngày.
c) Sục khí SO2¬ vào dd nước Br2. d) Cho H2SO4 đặc vào cốc chứa đường saccarozơ.
Câu 3: Viết phương trình hóa học chứng minh
a) Cl2 vừa có tính khử vừa có tính oxi hóa.
c) Tính oxi hóa của Br2 > I2.
d) Tính oxi hóa của O3 mạnh hơn O2.
Khí SO2¬ làm mất màu dd nước Br2.
Câu 4: Hòa tan 8,3 gam hỗn hợp gồm Al và Fe trong dung dịch HCl dư thu được 5,6 lít khí H¬2 (đkc) và dung dịch A.
a)Tính % khối lượng mỗi kim loại có trong hỗn hợp ban đầu ?
b)Tính thể tích dd HCl 2M ban đầu, biết người ta dùng dư 10% so với lí thuyết.
c)Tính nồng độ mol/lit của các chất có trong dung dịch A?
Câu 5: Hỗn hợp X gồm 11,2 gam Fe và 7,2 gam FeO. Cho toàn bộ hỗn hợp X tác dụng dung dịch H2SO4 loãng dư thu được dung dịch Y và V1 lít khí (đktc). Cô cạn dung dịch Y thu được m gam muối khan.
a) Tính m và V1.
b) Nếu cho toàn bộ hỗn hợp X ở trên tác dụng với dung dịch H2SO4 đặc, nóng dư thu được V2 lít khí SO2 (đktc, sản phẩm khử duy nhất). Tính V2.
Câu 6: Đun nóng hỗn hợp gồm 6,72 gam Fe và 3,2 gam S trong điều kiện không có không khí đến khi phản ứng hoàn toàn thu được chất X. Cho X tác dụng với dung dịch H2SO4 đặc nóng dư thu được V lít khí SO2 (đktc, sản phẩm khử duy nhất).
a) X chứa chất gì? Khối lượng bằng bao nhiều?
b) Tính V?
Câu 7: Cho m gam hỗn hợp X gồm Fe và Cu. Chia hỗn hợp X thành 2 phần bằng nhau.
Phần 1: cho tác dụng với dung dịch H2SO4 loãng, dư thu được 1,12 lít khí (đktc)
Phần 2: cho tác dụng vừa đủ với V lít dung dịch H2SO4 đặc, nguội (98% ,D= 1,84g/ml) thu được 4,1216 lít khí (đktc)
a, Tính m và phần trăm theo khối lượng mỗi kim loại trong X
b, Tính V
Câu 8: Cho cân bằng hoá học: N2(k) + 3H2(k) 2NH3(k) ∆H <0.
Cân bằng trên chuyển dịch theo chiều nào khi:
a) Thêm vào một lượng H2.
b) Tăng áp suất của hệ.
c) Tăng nhiệt độ của hệ.
Câu 9: Cân bằng hóa học sau được thiết lập trong bình kín:
2SO2(k) + O2(k) 2SO3(k) ∆H <0
Cân bằng phản ứng sẽ chuyển dịch về phía nào khi:
a. Thêm một lượng oxi vào hệ b. Giảm nhiệt độ của hệ c. Tăng áp suất của hệ.
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
II–Tự luận (5,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
a. Fe + Cl2 ……………………………………………………………………………………………
b. Ba(NO3)2 + MgSO4 …………………………………………………………………………………….
c. HCl + Mg(OH)2 ……………………………………………………………………………………….
d. P + H2SO4 đặc, nóng …………………………………………………………………………………
e. Al + H2SO4 đặc, nóng SO2 + H2S + ..... ……………………………………………………
(biết tỉ lệ mol SO2 và H2S là 1 : 3)
Bài 2. (2,5 điểm)
Hòa tan 22,8 gam hỗn hợp X gồm Mg và Fe vào dung dịch H2SO4 98% (đặc, nóng, dư). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và thu được dung dịch Y.
a. Tính thành phần % khối lượng mỗi kim loại trong X. (1,5 điểm)
b. Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 400 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO4 98% ban đầu. (0,5 điểm)
c. Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 2:1) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng. (0,5 điểm)
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
ĐỀ THAM KHẢO HÓA 11
A. PHẦN TRẮC NGHIỆM KHÁCH QUAN (7 điểm)
Câu 1: Etan có công thức phân tử là
A. C3H6. B. C3H8. C. C2H4. D. C2H6.
Câu 2: Chất nào sau đây là đồng phân của but – 2 – en?
A. But – 1 – en. B. But – 2 – in. C. But – 1 – in. D. Buta – 1,3 – đien.
Câu 3: Số liên kết đôi C=C trong phân tử isopren là
A. 2. B. 3. C. 4. D. 1.
Câu 4: Dãy đồng đẳng của benzen có công thức phân tử chung là
A. CnH2n + 2 với (n 1). B. CnH2n với (n 2). C. CnH2n – 2 với (n 3). D. CnH2n – 6 với (n 6).
Câu 5: Chất nào sau đây không làm mất màu dung dịch thuốc tím (KMnO4) ngay cả khi đun nóng?
A. Toluen B. Stiren C. Benzen D. Hexen
Câu 6: Ở điều kiện thường chất nào sau đây là chất lỏng?
A. Metan. B. Bezen. C. Etilen. D. Axetilen.
Câu 7: Tên thay thế của CH3OH là
A. etanol. B. metanol. C. propanol. D. ancol etylic.
Câu 8: Ancol etylic không tác dụng với chất nào sau đây?
A.Na. B. CuO (đun nóng). C. axit HBr (đun nóng). D. NaOH.
Câu 9: Glixerol có số nhóm hiđroxyl (-OH) trong phân tử là
A. 1. B. 2. C. 3 . D. 4.
Câu 10: Phenol không phản ứng với chất nào sau đây ?
A. Na. B. NaOH. C. NaHCO3. D. Br2.
Câu 11: Phenol rất độc, do đó khi sử dụng phenol phải hết sức cẩn thận. Công thức cấu tạo của phenol là
A. C6H5OH. B. C6H5CH2OH. C. C6H5CH3. D. C2H5OH.
Câu 12: Dung dịch nước của fomanđehit (fomon) được dùng làm chất tẩy uế, ngâm mẫu động vật làm tiêu bản, …. Công thức cấu tạo của fomanđehit là
A. HCHO. B. CH3CHO. C. C2H5CHO. D. (CH3)2CHCHO.
Câu 13:Chất nào sau đây tham gia phản ứng tráng bạc?
A. CH3OH. B. CH3CHO. C. C6H5OH. D. CH3COOH.
Câu 14: Anđehit axetic được điều chế trực tiếp từ chất nào sau đây?
A. metanol. B. propanol. C. etanol. D. phenol .
Câu 15: Công thức cấu tạo thu gọn của axit axetic là
A. CH3OH. B. CH3CHO. C. C6H5OH. D. CH3COOH.
Câu 16: Chất nào sau đây có nhiệt độ sôi cao nhất?
A. Axit fomic. B.Axit axetic . C. Etanal. D. Etan.
Câu 17: Đốt cháy hoàn toàn 0,015 mol C3H8, thu được H2O và m gam CO2. Giá trị của m là
A. 1,98. B. 0,54. C. 0,66. D.0,18 .
Câu 18: Chất nào sau đây là sản phẩm chính khi hiđrat hóa but – 1 – en?
A.CH3CH2CH(OH)CH3. B. CH3CH2CH2CH2OH. C. CH3CH2CH2CH3. D. CH3CH2CH2CH2Cl.
Câu 19: Phát biểu nào sau đây đúng?
A. Các hiđrocacbon thơm có nhiệt độ sôi tăng theo chiều tăng của phân tử khối.
B. Công thức phân tử của benzen là C8H8.
C. Toluen không làm mất màu dung dịch KMnO4 khi đun nóng.
D. Công thức phân tử chung dãy đồng đẳng của benzen là CnH2n-2 (n ).
Câu 20: Toluen tác dụng với Br2 ( t0) theo tỉ lệ mol 1:1, thu được chất hữu cơ X. Công thức cấu tạo thu gọn của X là
A.C6H5CH2Br . B. C6H5Br. C. CH3C6H4Br. D.C6H5CHBrCH2Br .
Câu 21: Cho a mol ancol CH3OH tác dụng hoàn toàn với kim loại Na dư, thu được 4,48 lít khí H2 (ở đktc). Giá trị của a là
A. 0,2. B. 0,6 . C. 0,4. D. 0,1.
Câu 22: Đun etanol với H2SO4 đặc ở 1800C, thu được chất nào sau đây?
A. Propen. B. Eten. C. Propan. D. Etan.
Câu 23: Chọn phát biểu sai:
A. Phenol có tính axit nhưng yếu hơn axit cacbonic.
B. Giữa nhóm -OH và vòng benzen trong phân tử phenol không có ảnh hưởng qua lại với nhau.
C. Phenol tác dụng được với natrihidroxit tạo thành muối và nước.
D. Dung dịch phenol không làm đổi màu quỳ tím vì tính axit của phenol rất yếu.
Câu 24: Cả phenol và ancol etylic đều phản ứng được với
A. Na B. NaOH C. Br2 D. NaHCO3.
Câu 25: Cho m gam CH3CHO tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 3,24 gam Ag. Giá trị của m là
A. 0,88. B. 0,44. C.1,32 . D. 0,66.
Câu 26: Hiđro hóa hoàn toàn metanal (xúc tác Ni,to), thu được sản phẩm là
A. axit axetic. B. ancol etylic. C. metanol. D. etilen.
Câu 27: Nhỏ dung dịch chất nào sau đây vào đá vôi, thấy có khí CO2 thoát ra?
A. Phenol. B. Axit axetic. C. Metanol. D. Propanal.
Câu 28: Để phân biệt ba dung dịch: dung dịch etanol, dung dịch glixerol và dung dịch phenol, ta lần lượt dùng các hóa chất nào sau đây ?
A. Na, nước Br2. B. NaOH, Na C. nước Br2, Cu(OH)2 D. nước Br2, Na.
B.PHẦN TỰ LUẬN (3 điểm)
Câu 29 (1 điểm). Hoàn thành các phương trình hóa học sau
a) C6H5OH + NaOH b) CH3COOH + Na2CO3
c) C2H5OH + O2(dư) d) CH2=CH2 + HCl
Câu 30 (1 điểm). X là ancol no, đơn chức mạch hở. Cho 3,6 gam X tác dụng với Na dư thu được 0,672 lít H2 (ở đktc). Viết công thức cấu tạo và gọi tên của X.
Câu 31 (0,5 điểm). Chia m gam hỗn hợp A gồm axit axetic và ancol etylic thành 2 phần bằng nhau.
Phần 1: tác dụng hết với Na dư thu được 2,24 lit khí H2 (đktc).
Phần 2: trung hòa vừa đủ với 150 ml dd NaOH 1M.
Tính m?
Câu 32 (0,5 điểm). Hợp chất hữu cơ X (phân tử có vòng benzen) có CTPT là C7H8O2 , tác dụng được với Na và với NaOH. Biết:
- Khi cho a mol X tác dụng với Na dư thì thu được a mol khí H2.
- a mol X tác dụng vừa đủ với a mol dung dịch NaOH.
Xác định công thức cấu tạo thu gọn của X?
(Cho Ag= 108, C=12, H=1,O=16)
................HẾT.................
ĐỀ SỐ 2
(Biết C = 12; H = 1; O = 16; N = 14; Ag = 108; Na = 23; K = 39; Br = 80)
I. PHẦN TRÁC NGHIỆM (7 điểm)
Câu 1. Trong số các chất sau chất nào tác dụng được với dung dịch AgNO3 trong NH3 tạo kết tủa vàng?
A. B. CH3-CH=CH2 C. CH3-CH2-CH3 D. CH3-CH3
Câu 2. Dãy đồng đẳng anken có công thức phân tử chung là
A. CnH2n-2(n 2) B. CnH2n+2(n 1) C. CnH2n+1 (n 1) D. CnH2n(n 2)
Câu 3. Hiện nay nhiều nơi ở nông thôn đang sử dụng hầm biogas để xử lí chất thải trong chăn nuôi gia súc, cung cấp nhiên liệu cho việc đun nấu. Thành phần chính trong khí biogas là khí metan. Khí metan có công thức phân tử là
A. C3H6 B. C2H4 C. CH4 D. C2H2
Câu 4. Theo danh pháp IUPAC, hợp chất CH3-CH2-COOH có tên gọi là
A. Axit pentannoic B. Axit butanoic C. Axit propanoic D. Axit metanoic
Câu 5. Dẫn V lít (ở đktc) hỗn hợp X gồm axetilen và hiđro đi qua ống sứ đựng bột niken nung nóng, thu được khí Y. Dẫn Y vào lượng dư AgNO3 trong dung dịch NH3thu được 12 gam kết tủA. Khí đi ra khỏi dung dịch phản ứng vừa đủ với 16 gam brom và còn lại khí Z. Đốt cháy hoàn toàn khí Z thu được 2,24 lít khí CO2(ở đktc) và 4,5 gam nước. Giá trị của V bằng?
A. 11,2 lít B. 5,60 lít C. 8,96 lít D. 13,44 lít
Câu 6. Ancol là những hợp chất hữu cơ trong phân tử có nhóm…(1)….liên kết trực tiếp với….(2)…….. Điền cụm từ thích hợp vào (1) và (2).
A. , nguyên tử cacbon hoặc nguyên tử hiđro
B. –COOH (cacboxyl), nguyên tử cacbon hoặc nguyên tử hiđro
C. –OH (hiđroxyl), nguyên tử cacbon no
D. –CH=O, nguyên tử cacbon hoặc nguyên tử hiđro
Câu 7. Hóa hơi 8,64 gam hỗn hợp gồm một axit no, đơn chức, mạch hở X và một axit no, đa chức Y (có mạch cacbon hở, không phân nhánh) thu được một thể tích hơi bằng thể tích của 2,8 gam N2 (đo trong cùng điều kiện nhiệt độ, áp suất). Đốt cháy hoàn toàn 8,64 gam hỗn hợp hai axit trên thu được 11,44 gam CO2. Tính phần trăm khối lượng của X trong hỗn hợp ban đầu.
A. 72,22 % B. 35,25 % C. 65,15 % D. 27,78 %
Câu 8. Khi cho CH3-CH2-CH3 tác dụng với Cl2 (ánh sáng, tỉ lệ mol 1:1). Số sản phẩm monoclo tối đa thu được là
A. 1 B. 2 C. 4 D. 3
Câu 9. Nhóm chức của anđehit là
A. -NH2 B. -COOH C. -CHO D. -OH
Câu 10. Cho 4,6 gam glixerol tác dụng hết với V ml dung dịch HCl 1M. Giá trị của V bằng?
A. 250ml B. 300 ml C. 150ml D. 200ml
Câu 11. Giấm là một chất lỏng có vị chua, được hình thành nhờ sợ lên men của ancol etylic. Thành phần chính của giấm là axit axetic có nồng độ từ 2% đến 5%. Axit axetic có công thức?
A. C2H5OH B. CH3COOH C. CH3OH D. HCHO
Câu 12. Trước kia thuốc trừ sâu 666 được sử dụng rộng rãi trong nền nông nghiệp nhưng do chất này có độc tính cao và phân hủy chậm nên đã bị cấm sử dụng tại 169 quốc gia tham gia công ước Stockholm. Chất được sử dụng làm thuốc trừ sâu 666 có công thức là
A. C2H2 B. C6H6Cl6 C. C4H6 D. C3H8
Câu 13. Cho phản ứng:
Xác định vai trò của CH3CHO trong phản ứng trên
A. Chất khử B. Axit C. Chất oxi hóa D. Bazơ
Câu 14. Để trung hòa hoàn toàn 6 gam axit axetic cần dùng V lít dung dịch NaOH 1M. Giá trị của V?
A. 0,05 lít B. 0,1 lít C. 0,2 lít D. 0,15 lít
Câu 15. Sản phẩm sinh ra trong thí nghiệm sau là gì?
A. CH3COOH B. (CH3CH2)2O C. CH3−CO−CH3 D. CH3CHO
Câu 16. Tính chất hóa học đặc trưng của ankan?
A. Phản ứng cộng B. Phản ứng trùng hợp
C. Phản ứng thế D. Phản ứng tách
Câu 17. Khí axetilen là nhiên liệu trong đèn xì oxi – axetilen đề hàn cắt kim loại vì phản ứng cháy của khí axetilen trong oxi tỏa ra lượng nhiệt rất lớn. Thể tích khí oxi (ở điều kiện tiêu chuẩn) cần để đốt cháy hết 1 mol khí axetilen là
A. 56 lít B. 112 lít C. 70 lít D. 65 lít
Câu 18. Dãy đồng đẳng của benzen (C6H6)có công thức phân tử chung là
A. CnH2n(n 2) B. CnH2n+2 (n 1)
C. CnH2n-6 (n 6) D. CnH2n-2 (n 2)
Câu 19. Phenol có công thức là
A. CH3OH B. CH3COOH C. C6H5OH D. C2H4
Câu 20. Ankađien là những hiđrocacbon mạch hở trong phân tử
A. Có 1 liên kết đôi C=C B. Chỉ có liên kết đơn
C. Có 2 liên kết đôi C=C D. Có 1 liên kết C C
Câu 21: Làm thí nghiệm như hình vẽ
Hiện tượng xảy ra trong ống nghiệm khi cho dư glixerol (C3H5(OH)3), lắc đều là gì?
A. Kết tủa tan, tạo dung dịch có màu xanh lam.
B. Không có hiện tượng gì.
C. Kết tủa vẫn còn, dung dich có màu trong suốt.
D. Kết tủa tan, dung dịch có màu nâu đỏ
Câu 22: Chất có công thức CH CH có tên gọi là
A. Etan. B. Metan. C. Etilen. D. Axetilen.
Câu 23: Đốt cháy hoàn toàn một ancol đơn chức (X) thu được 4,48 lít khí CO2 (đktc) và 4,5 gam H2O. Công thức của ancol (X) là
A. C3H7OH. B. C4H9OH. C. C2H5OH. D. CH3OH.
Câu 24: Thuốc thử để phân biệt hai khí but -2-in, but-1-in là
A. Dung dịch AgNO3 /NH3. B. Dung dịch KMnO4.
C. Dung dịch HCl. D. Dung dịch Br2.
Câu 25: Cho 0,94 gam phenol( C6H5OH) tác dụng vừa đủ với Vml dung dịch NaOH 1M. Giá trị của V là
A. 40ml B. 20ml C. 30ml D. 10ml
Câu 26: Dẫn 4,48 lít (đktc) hỗn hợp X gồm hai anken đồng đẳng kế tiếp qua bình đựng dung dịch brom dư thấy khối lượng bình sau phản ứng tăng thêm 7 gam. Biết các phản ứng xảy ra hoàn toàn. Công thức phân tử của 2 anken là
A. C4H8 và C5H10. B. C3H6 và C4H8.
C. C2H4 và C3H6. D. C5H10 và C6H12.
Câu 27: Metan là ankan có trong thành phần chính của khí thiên nhiên, khí biogas. Metan có công thức là
A. C2H6 B. C2H4 C. C2H2. D. CH4
Câu 28: Cho đốt cháy hết m gam hỗn hợp X các ancol trong dãy đồng đẳng thì thu được 11,2 lít khí CO2 ở đktc và 12,6 gam nước. Vậy m gam hỗn hợp X tác dụng với Na dư thì lượng khí H2 thoát ra là V lít(đktc). Giá trị lớn nhất của V là
A. 6,72. B. 2,24. C. 4,48. D. 3,36.
II. PHẦN TỤ LUẬN (3 ĐIỂM)
Câu 1: (1 điểm)
a. Gọi tên các hợp chất sau: CH3OH; CH3-CHO
b. Viết công thức cấu tạo thu gọn các hợp chất sau: axit fomic, butan-2-ol
Câu 2: (1 điểm) Bằng phương pháp hóa học hãy nhận biết các ống nghiệp đựng các dung dịch hóa chất sau: Axit axetic (CH3COOH), ancol etylic (C2H5OH), phenol (C6H5OH).
Câu 3: (0,5 điểm) Cho 9 gam một axit cacboxylic no, đơn chức, mạch hở tác dụng với natri dư thì thu được 1,68 lít khí H2 (đktc). Xác định công thức của axit cacboxylic?
Câu 4: (0,5 điểm) Cho sơ đồ phản ứng sau:
Metan X Y Z T
Xác định công thức các chất X, Y, Z, T và viết các phương trình (1), (2), (3), (4). Biết T là chất no đơn chức và có 4 nguyên tử cacbon trong phân tử
(Học sinh không được sử dụng tài liệu)
------ HẾT ------
ĐỀ SỐ 3
I. PHẦN TRẮC NGHIỆM (7 ĐIỂM)
Cho nguyên tử khối của các nguyên tố (đvC): H=1; He=4; C=12; N=14; O=16; Na=23; Mg=24; Al=27; P=31; S=32; Cl=35,5; K=39; Ca=40; Fe=56; Cu=64; Br=80; Ag=108; Ba=137;
Câu 1: Đun nóng butan-2-ol trong điều kiện H2SO4 đặc, 1700C tạo ra tối đa bao nhiêu anken là đồng phân của nhau (tính cả đồng phân hình học cis, trans)?
A. 3 B. 2 C. 1 D. 4
Câu 2: Metanol là một độc tố ngây chết người hàng đầu trong các vụ ngộ độc rượu. Công thức phân tử của metanol là
A. HCHO. B. C6H5OH. C. CH3OH. D. C6H5CH2OH.
Câu 3: Tên thay thế của ancol có công thức cấu tạo thu gọn CH3CH2CH2OH là
A. propan-2-ol. B. pentan-1-ol. C. pentan-2-ol. D. propan-1-ol.
Câu 4: Đun nóng một ancol đơn chức X thu được 14,8 gam ete và 3,6 gam H2O. Công thức ancol X là
A. C3H5OH. B. C3H7OH C. C4H7OH. D. C2H5OH.
Câu 5: Thủy phân chất X trong nước thu được khí metan. Vậy X là
A. Al4C3. B. CaO. C. Na. D. CaC2.
Câu 6: Cho 0,01 mol phenol (C6H5OH) tác dụng vừa đủ với dung dịch Br2 loãng thu được m gam kết tủa trắng là 2,4,6 -tribromphenol. Giá trị của m là
A. 3,31. B. 6,62 C. 9,93. D. 4,43.
Câu 7: Hỗn hợp E gồm ancol etylic và hai hiđrocacbon mạch hở thuộc cùng dãy đồng đẳng. Hóa hơi m gam E thu được thể tích bằng với thể tích của 0,96 gam khí O2 ở cùng điều kiện. Mặt khác đốt cháy m gam E cần vừa đủ 0,3 mol O2, sau phản ứng thu được 0,195 mol CO2. Khối lượng C2H5OH trong hỗn hợp hợp E là
A. 0,92 gam. B. 0,69 gam. C. 0,46 gam. D. 0,23 gam.
Câu 8: Chất nào mất màu dung dịch Br2 là
A. Benzen B. Hexan C. Etilen D. Metan
Câu 9: Công thức tổng quát của ancol no, đơn chức, mạch hở là
A. CnH2n-1OH. B. CnH2n+2-OH. C. CnH2n-2-OH. D. CnH2n+1-OH.
Câu 10: Cho 224 ml khí etilen ở đktc phản ứng vừa đủ với V ml dung dịch Br2 0,5M. Giá trị của V là
A. 10 B. 20. C. 40 D. 80
Câu 11: Cho 12 gam ancol X no, đơn chức, mạch hở phản ứng với Na (dư) thu được 2,24 lit khí H2 (đktc). Công thức phân tử của X là:
A. C3H7OH. B. C2H5OH. C. CH3OH. D. C4H9OH
Câu 12: Đun nóng 11,6 gam C4H10 một thời gian, thu được hỗn hợp X gồm chất: H2, CH4, C2H6, C4H8, C3H6, C2H4, C4H10. Đốt cháy hoàn toàn X rồi cho sảng phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư, thấy khối lượng bình tăng lên m gam. Giá trị của m là?
A. 80,0. B. 35,2. C. 18.0. D. 53,2.
Câu 13: Đốt cháy hoàn toàn một hiđrocacbon X thu được 6,72 lít CO2 (đktc) và 7,2 gam H2O. CTPT của X là:
A. C2H6 B. C3H8 C. C4H10 D. C3H6
Câu 14: Đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm các ankan thu được 0,35 mol CO2 và m gam H2O. Giá trị của m là
A. 8,1 B. 9,0 C. 4,5 D. 7,2
Câu 15: Dãy đồng đẳng của axetilen hay ankin có công thức chung là
A. CnH2n+2 (n ≥ 2) B. CnH2n (n ≥ 2)
C. CnH2n-2 (n ≥ 2) D. CnH2n-6 (n ≥ 6)
Câu 16: Số đồng phân cấu tạo ancol ứng với công thức phân tử C4H10O là
A. 5. B. 3. C. 4. D. 2.
Câu 17: Ancol X là một ancol khi đốt cháy m gam thu được a mol CO2, còn nếu cho 2 m gam X tác dụng với Na dư thấy cũng thu được a mol khí H2. Vậy X là
A. Ancol etylic. B. Glixerol.
C. Ancol benzylic. D. Propan – 1,2 – điol.
Câu 18: Chất không tham gia phản ứng cộng với H2( Ni, t0) là
A. CH CH B. CH3-CH3
C. CH2=CH2 D. CH2=CH-CH=CH2
Câu 19: Cho 1 mẩu Na nhỏ bằng hạt đậu vào ống nghiệm chứa 2 - 3 ml chất lỏng X, thấy giải phóng khí Y. Đốt cháy Y trong không khí, thấy Y cháy với ngọn lửa màu xanh nhạt. Chất X là
A. benzen. B. Đietyl ete. C. Hexan. D. Etanol.
Câu 20: Nhỏ dung dịch Br2 loãng vào dung dịch chứa chất X nhận thấy nước brom mất màu, đồng thời có kết tủa trắng xuất hiện. Vậy X là
A. C2H5OH B. C6H5OH
C. C6H5-CH=CH2 D. CH3COOH
Câu 21: Phenol (C6H5OH) không phản ứng với chất nào sau đây?
A. Na. B. NaOH.
C. Dung dịch HCl. D. Dung dịch Br2.
Câu 22: Xăng sinh học E5 đang được khuyến khích người tiêu dùng sử dụng, là loại xăng có chứa 5% về thể tích etanol. Etanol là tên gọi của chất nào?
A. CH3OH. B. CH3CHO. C. C3H8O3. D. C2H5OH.
Câu 23: Đun nóng ancol etylic với H2SO4 đặc ở 170°C, thu được một hiđrocacbon có công thức là
A. C2H2. B. C2H6. C. C2H4. D. CH4.
Câu 24: Chất có hai liên kết đôi trong phân tử là?
A. CH2=CH-CH=CH2 B. CH2=CH-C CH
C. CH2=CH2 D. CH3-CH2- C CH
Câu 25: Ankan X có tỷ khối hơi so với H2 là 29. Vậy công thức của X là
A. C4H10 B. C4H8 C. C2H6 D. C3H8
Câu 26: Công thức CH¬2=CH2 có tên gọi là
A. Propilen. B. Etilen. C. Etan. D. Axetilen.
Câu 27: Khi cho 4,6 gam ancol etylic tác dụng hết với Na dư, thu được V lít khí H2 (đktc). Giá trị của V là
A. 4,48 lít. B. 1,12 lít. C. 3,36 lít. D. 2,24 lít.
Câu 28: Dẫn khí X đi qua dung dịch AgNO3/NH3 nhận thấy có kết tủa vàng nhạt xuất hiện. Vậy X là
A. CH CH B. CH2=CH2 C. CH4 D. CH3-CH3
II. PHẦN TỤ LUẬN (3 ĐIỂM)
Câu 1: (1 điểm)
Hoàn thành các phương trình hóa học sau
a) C6H5OH + NaOH b) CH3COOH + Na2CO3
c) C2H5OH + O2(dư) d) CH2=CH2 + HCl
Câu 2: (1 điểm) Bằng phương pháp hóa học hãy nhận biết các ống nghiệp đựng các dung dịch hóa chất sau: Axit axetic (CH3COOH), ancol etylic (C2H5OH), phenol (C6H5OH).
Câu 3: (0,5 điểm) : Đốt cháy hoàn toàn hỗn hợp các anken bằng oxi thu được 7,84 lít CO2(đktc) và m gam H2O. Giá trị của m là bao nhiêu?
Câu 4: (0,5 điểm) Đun nóng 11,6 gam C4H10 một thời gian, thu được hỗn hợp X gồm chất: H2, CH4, C2H6, C4H8, C3H6, C2H4, C4H10. Đốt cháy hoàn toàn X rồi cho sảng phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư, thấy khối lượng bình tăng lên m gam. Giá trị của m là?
(Học sinh không được sử dụng tài liệu)
------ HẾT ------
ĐỀ THAM KHẢO HÓA 12
ĐỀ 1
PHẦN TRẮC NGHIỆM: 7,0 điểm
Câu 1: Để điều chế kim loại kiềm, người ta dùng phương pháp nào sau đây?
A. Điện phân nóng chảy. B. Điện phân dung dịch. C. Thủy luyện. D. Nhiệt luyện.
Câu 2: Trong các hợp chất, K có số oxi hóa là
A. 0 và +1. B. +1. C. +1 và +2. D. +1 và -1.
Câu 3: Dung dịch thu được khi hòa tan kim loại Na vào nước là
A. NaOH. B. Na(OH)2. C. Na(OH)3. D. Na2O .
Câu 4: Kim loại nào sau đây là kim loại kiềm thổ?
A. Na. B. Fe. C. Ca. D. Cu.
Câu 5: Kim loại nào sau đây không tan trong nước ở bất kì nhiệt độ nào?
A. Ba. B. Ca. C. Mg. D. Be.
Câu 6: Công thức hóa học của thạch cao sống là
A. CaSO4.2H2O. B. CaSO4. C. CaSO4.3H2O. D. CaSO4.5H2O.
Câu 7: Nước cứng là nước có chứa nhiều ion
A. Mg2+, Ca2+. B. Ba2+, Mg2+. C. Cu2+, Mg2+. D. Na+, Ca2+.
Câu 8: Phèn chua được dùng trong ngành thuộc da, công nghiệp giấy, chất cầm màu trong công nghiệp nhuộm, chất làm trong nước. Công thức hóa học của phèn chua là
A. KAl(SO4)2.12H2O. B. NaAl(SO4)2.12H2O. C. NH4Al(SO4)2.12H2O. D. LiAl(SO4)2.12H2O.
Câu 9: Quặng nào sau đây dùng để sản xuất nhôm?
A. Boxit. B. Đolomit. C. Apatit. D. Pirit.
Câu 10: Tính chất vật lý nào dưới đây không phải của Fe?
A. Kim loại nặng, khó nóng chảy. B. Dẫn điện và dẫn nhiệt tốt.
C. Màu vàng nâu, dẻo, dễ rèn. D. Có tính nhiễm từ.
Câu 11: Fe phản ứng với dung dịch nào sau đây tạo khí H2?
A. H2SO4 loãng. B. HNO3. C. CuSO4. D. AgNO3.
Câu 12: Trong các loại quặng sắt, quặng có hàm lượng sắt cao nhất là
A. hematit nâu. B. manhetit. C. xiđerit. D. hematit đỏ.
Câu 13: Gang là hợp kim của
A. sắt với cacbon. B. sắt với photpho. C. sắt với lưu huỳnh. D. sắt với nhôm.
Câu 14: Các số oxi hóa thường gặp của Cr trong hợp chất là:
A. +1, +2, +6. B. +3, +4, +6. C. +2, +3, +6. D. +2, +4, +6.
Câu 15: Chất nào sau đây là oxit axit?
A. CrO3. B. FeO. C. Cr2O3. D. Fe2O3.
Câu 16: Tác nhân nào sau đây là nguyên nhân chính gây ra mưa axit?
A. NO2, SO2. B. SO3, CO2. C. CO2, NO2. D. N2, H2.
Câu 17: Khối lượng quặng boxit chứa 75% Al2O3 cần để sản xuất 1,5 tấn nhôm nguyên chất là (biết hiệu suất phản ứng điện phân đạt 90%)
A. 7,6 tấn. B. 8,4 tấn. C. 4,2 tấn. D. 3,8 tấn.
Câu 18: Hiện tượng xảy ra khi cho kim loại Na vào dung dịch CuSO4 là
A. sủi bọt khí không màu và có kết tủa màu xanh.
B. bề mặt kim loại có màu đỏ, dung dịch nhạt màu.
C. sủi bọt khí không màu và có kết tủa màu đỏ.
D. bề mặt kim loại có màu đỏ và có kết tủa màu xanh.
Câu 19: Nung hỗn hợp gồm MgCO3 và BaCO3 có cùng số mol đến khối lượng không đổi thu được khí X và chất rắn Y. Hòa tan Y vào nước dư, lọc bỏ kết tủa thu được dung dịch Z. Hấp thụ hoàn toàn khí X vào dung dịch T, sản phẩm sau phản ứng là
A. Ba(HCO3)2. B. BaCO3 và Ba(HCO3)2.
C. BaCO3 và Ba(OH)2. D. BaCO3.
Câu 20: Cho mẫu kim loại Mg vào dung dịch HNO3 loãng, sau phản ứng chỉ thu được dung dịch X. Muối có trong dung dịch X là
A. Mg(NO3)2. B. NH4NO3. C. Mg(NO3)2, NH4NO3. D. Mg(NO3)2, NH4NO2.
Câu 21: Dung dịch chất nào sau đây không thể hòa tan Al2O3?
A. NaOH. B. H2SO4. C. NH3. D. Ba(OH)2.
Câu 22: Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là
A. có kết tủa keo trắng và có khí thoát ra. B. có kết tủa keo trắng, sau đó kết tủa tan.
C. không có kết tủa, có khí thoát ra. D. chỉ có kết tủa keo trắng.
Câu 23: Hoà tan hoàn toàn m gam Fe trong dung dịch HNO3 loãng dư, sau khi phản ứng kết thúc thu được 0,448 lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A.11,2. B. 0,56. C. 5,60. D. 1,12.
Câu 24 :Hợp chất FeO thể hiện tính khử trong phản ứng với chất nào sau đây?
A. Dung dịch HNO3. B. Dung dịch HCl.
C. CO. D. Dung dịch H2SO4 loãng.
Câu 25 : Phương trình hóa học nào sau đây không đúng?
A. 2Cr + 3H2SO4 (loãng) Cr2(SO4)3 + 3H2.
B. 2Cr + 3Cl2 2CrCl3.
C. Cr(OH)3 + 3HCl CrCl3 + 3H2O.
D. Cr2O3 + 2NaOH (đặc) 2NaCrO2 + H2O.
Câu 26 : Cho các phát biểu sau:
(a) Lưu huỳnh, photpho, cacbon đều phản ứng với CrO3.
(b) Bột nhôm dễ phản ứng với khí Cl2.
(c) Phèn chua có công thức là KAl(SO4)2.12H2O.
(d) Cr2O3 là oxit lưỡng tính.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
Câu 27 : Hòa tan hoàn toàn hỗn hợp X gồm 0,02 mol Cr và 0,03 mol Fe trong trong dung dịch H2SO4 loãng dư thu được V lít H2 (đktc). Giá trị của V là
A. 1,120. B. 2,240. C. 0,448. D. 0,672.
Câu 28 : Cho các phát biểu sau:
(a) Trong tự nhiên, kim loại kiềm chỉ tồn tại dạng hợp chất.
(b) Al tác dụng mạnh với dung dịch HNO3 đặc nóng và H2SO4 đặc nóng.
(c) Có thể dùng dung dịch Na2CO3 để làm mềm nước cứng tạm thời.
(d) Hỗn hợp Cu và Fe2O3 với tỷ lệ mol 1 : 1 có thể tan hết trong nước dư.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
PHẦN TỰ LUẬN: 3,0 điểm
Câu 29 (1 điểm): Viết phương trình hóa học điều chế kim loại Ca từ CaCO3.
Câu 30 (1 điểm): Hòa tan hết 7,3 gam hỗn hợp bột Na, Al vào nước thu được 5,6 lít H2 (đktc).
a. Viết phương trình hóa học của các phản ứng xảy ra.
b. Tính phần trăm khối lượng của mỗi kim loại trong hỗn hợp.
Câu 31 (0,5 điểm): Hòa tan hoàn toàn 5,584 gam hỗn hợp Fe và Fe3¬O4 vào dung dịch HNO3 loãng, dư. Sau khi phản ứng hoàn toàn thu được 0,3136 lít khí NO (đktc, sản phẩm khử duy nhất của N+5) và dung dịch X chứa m gam muối. Tính giá trị m.
Câu 32 (0,5 điểm): Xác định các chất X, Y và viết phương trình hóa học của các phản ứng trong sơ đồ chuyển hóa sau:
NaOH X Y NaOH
------------------ Hết -----------------
ĐỀ 2
PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1. Kim loại nào sau đây được điều chế bằng phương pháp điện phân dung dịch?
A. Ba. B. Ag. C. Na. D. Ca.
Câu 2: Trong các hợp chất, Na có số oxi hóa là
A. 0 và +1. B. +1. C. +1 và +2. D. +1 và -1.
Câu 3: Natrihidrocacbonat có công thức phân tử là
A. NaOH. B. NaHCO3. C. NaCl. D. Na2SO4.
Câu 4: Trong bảng tuần hoàn, các kim loại kiềm thuộc nhóm
A. IA. B. IIA. C. IIIA. D. VA.
Câu 5: Sản phẩm thu được khi đốt Mg trong bình đựng khí clo là
A. MgCl2. B. MgCl. C. MgCl3. D. MgO.
Câu 6: Công thức hóa học của thạch cao nung là
A. CaSO4.2H2O. B. 2CaSO4.H2O. C. CaSO4.3H2O. D. CaSO4.
Câu 7: Cách làm mềm nước cứng tạm thời nào sau đây là đơn giản nhất?
A. Đun sôi B. Dùng dung dịch HCl loãng. C. Dùng dung dịch Na2CO3. D. Dùng dung dịch nước vôi trong.
Câu 8: Kim loại Al không có tính chất vật lí nào sau đây?
A. Dễ dát mỏng. B. Khối lượng riêng lớn C. Màu trắng bạc. D. Khá mềm.
Câu 9: Ứng dụng nào sau đây không đúng với nhôm và hợp kim của nhôm?
A. Hàn đường ray. B. Dụng cụ nhà bếp C. Chế tạo máy bay, ô tô, tên lửa. D. Dụng cụ y tế
Câu 10: Cấu hình electron nào sau đây là của ion Fe3+?
A. [Ar]3d6. B. [Ar]3d5. C. [Ar]3d4. D. [Ar]3d3.
Câu 11: Phương trình hóa học nào sau đây đúng?
A. Fe + H2SO4 → FeSO4 + H2. B. 2Fe + 6HCl → 2FeCl3 + 3H2.
C. Fe + 3AgNO3 → Fe(NO3)3 + 3Ag. D. Fe + Cl2 → FeCl2.
Câu 12: Công thức hóa học của sắt(II) clorua là
A. FeCl2. B. Fe(OH)3. C. FeSO4. D. Fe2O3.
Câu 13: Phát biểu nào sau đây không đúng?
A. Nguyên liệu sản xuất gang gồm quặng sắt, than cốc và chất chảy.
B. Chất khử trong quá trình sản xuất gang là cacbon monooxit.
C. Thép là hợp kim của sắt, chứa từ 0,01-2% khối lượng cacbon, ngoài ra còn có một số nguyên tố khác.
D. Để chuyển hóa gang thành thép có thể dùng bột nhôm để khử oxit sắt.
Câu 14: Trong các kim loại: Fe, Al, Na, Cr, kim loại cứng nhất là
A. Fe. B. Au. C. W. D. Cr.
Câu 15: Hợp chất nào sau đây có tính lưỡng tính?
A. CrCl3. B. NaOH. C. KOH D. Cr(OH)3.
Câu 16: Chất bột được dùng để khử tính độc của thuỷ ngân là
A. vôi sống. B. cát. C. lưu huỳnh. D. muối ăn.
Câu 17: Nguyên tắc chung để điều chế kim loại là
A. khử ion kim loại thành kim loại. B. oxi hóa kim loại thành ion kim loại.
C. oxi hóa ion kim loại thành kim loại. D. khử ion kim loại thành nguyên tử.
Câu 18: Cho 2,34 gam kim loại M thuộc nhóm IA phản ứng với H2O thu được 0,672 lit khí H2 (đktc) . Kim loại M là
A. K. B. Na. C. Li. D. Ag.
Câu 19: Dãy chất nào sau đây đều tác dụng với dung dịch Ca(OH)2?
A. Ca(HCO3)2, Na2CO3. B. MgO, HCl. C. NaHCO3, NaCl. D. Mg(OH)2, HCl.
Câu 20: Ứng dụng nào sau đây không phải của CaCO3?
A. Làm vôi quét tường. B. Làm vật liệu xây dựng.C. Sản xuất ximăng D. Sản xuật bột nhẹ để pha sơn.
Câu 21: Nhóm gồm tất cả các chất vừa tác dụng với dung dịch NaOH, vừa tác dụng với dung dịch HCl là
A. AlCl3, Al(OH)3. B. NaAlO2, Al2O3. C. Al2O3, Al(OH)3. D. Al2(SO4)3, NaAlO2.
Câu 22: Cho m gam Al phản ứng vừa đủ với 0,039 mol Cl2. Giá trị của m là
A. 1,053. B. 0,702. C. 0,175. D. 0,351.
Câu 23: Hòa tan 5,6 gam Fe trong lượng dư dung dịch HNO3 đặc nóng thấy thoát ra V lít khí NO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
A. 2,240. B. 4,480. C. 6,720. D. 8,960.
Câu 24: Thí nghiệm nào sau đây thu được muối sắt (III)?
A. Cho Fe(OH)2 vào dung dịch H2SO4 loãng. B. Cho Fe dư vào dung dịch Fe(NO3)3.
C. Cho Fe vào dung dịch HNO3 loãng, dư. D. Cho FeO vào dung dịch HCl.
Câu 25: Dung dịch X có màu đỏ cam. Nếu cho thêm vào một lượng KOH, màu đỏ của dung dịch dần dần chuyển sang màu vàng tươi. Nếu thêm vào đó một lượng H2SO4, màu của dung dịch dần dần trở lại đỏ cam. Dung dịch X là
A. K2Cr2O7. B. K2Cr2O4. C. KCr2O4. D. KMnO4.
Câu 26: Cho các phát biểu sau:
(1) Dẫn CO2 dư vào dung dịch Ca(OH)2, kết thúc phản ứng thu được kết tủa.
(2) Crom là kim loại có tính khử mạnh hơn sắt.
(3) Nhỏ đến dư dung dịch NH3 vào dung dịch AlCl3 thấy xuất hiện kết tủa.
(4) CaSO4.H2O được dùng để bó bột, nặng tượng và đúc khuôn.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 27: Thí nghiệm nào sau đây không thu được kết tủa?
A. Cho dung dịch KOH vào dung dịch FeCl3.
B. Cho dung dịch AgNO3 vào dung dịch Na3PO4.
C. Cho dung dịch NaOH dư vào dung dịch Al(NO3)3.
D. Cho dung dịch BaCl2 vào dung dịch K2SO4.
Câu 28: Cho các thí nghiệm sau (các phản ứng xảy ra hoàn toàn):
(a) Cho hỗn hợp Na và Al (tỉ lệ mol 3:1) vào nước dư;
(b) Cho hỗn hợp BaO và NH4Cl (tỉ lệ mol 1:2) vào nước dư;
(c) Cho Mg vào dung dịch HNO3 loãng dư, không có khí thoát ra;
(d) Sục khí CO2 dư vào dung dịch Ba(OH)2;
(e) Cho 1,2x mol Fe vào dung dịch chứa 4x mol HNO3 đun nóng (NO là sản phẩm khử duy nhất).
Số thí nghiệm thu được dung dịch chứa hai chất tan là
A. 4. B. 2. C. 5. D. 3.
PHẦN TỰ LUẬN:
Câu 29 (1,0 điểm): Viết phương trình hóa học các phản ứng trong sơ đồ chuyển hóa sau:
Fe FeBr3 Fe(OH)3¬ Fe2O3 Fe3O4
Câu 20 (1,0 điểm): Cho m gam hỗn hợp X gồm Al và Cr tác dụng với dung dịch HCl loãng, nóng dư thu được 10,08 lít H2 (đktc). Cũng lượng hỗn hợp X trên tác dụng với lượng dư dung dịch NaOH thu được 6,72 lít H2 (đktc).
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính m.
Câu 31 (0,5 điểm): Có 4 mẫu bột kim loại: K, Al, Fe, Ca. Chỉ dùng nước làm thuốc thử, trình bày cách nhận biết 4 kim loại trên.
Câu 32 (0,5 điểm): Cho một luồng khí CO đi qua ống sứ đựng 0,04 mol hỗn hợp A gồm FeO và Fe2O3 đốt nóng. Sau khi kết thúc thí nghiệm thu được hỗn hợp B gồm bốn chất nặng 4,784 gam. Khí đi ra khỏi ống sứ cho hấp thụ vào dung dịch Ba(OH)2 dư tạo thành 9,062 gam kết tủa.Tính thành phần phần trăm của khối lượng của từng chất trong hỗn hợp A.
ĐỀ 3
PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1. Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
A. Ag. B. Na. C. Fe. D. Cu.
Câu 2. Ở nhiệt độ thường, kim loại Na phản ứng với H2O, thu được H2 và chất nào sau đây?
A. NaCl. B. Na2O. C. NaOH. D. Na2O2.
Câu 3. Kim loại nào sau đây là kim loại kiềm?
A. Ca. B. K. C. Cu. D. Al.
Câu 4. Khi so sánh với kim loại kiềm cùng chu kì, nhận xét nào dưới đây đúng về kim loại kiềm thổ?
A. Khối lượng riêng nhỏ hơn. B. Độ cứng lớn hơn.
C. Nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn. D. Thế điện cực chuẩn nhỏ hơn.
Câu 5. Để phân biệt dung dịch CaCl2 với dung dịch NaCl, người ta dùng dung dịch
A. HNO3. B. Na2CO3. C. NaNO3. D. KNO3.
Câu 6. Nước cứng là nước
A. chứa nhiều ion Ca2+ , Mg2+. B. chứa một lượng cho phép Ca2+ , Mg2+.
C. không chứa Ca2+ , Mg2+ D. chứa nhiều Ca2+ , Mg2+ , HCO3-.
Câu 7. Thạch cao nung có công thức hóa học là
A. CaCO3. B. CaSO4.2H2O. C. CaSO4. D. CaSO4.H2O.
Câu 8. Phát biểu nào sau đây không đúng với nhôm?
A. Ở ô thứ 12, chu kì 3, nhóm IIIA. B. Cấu hình electron nguyên tử: [Ne] 3s23p1.
C. Mức oxi hóa đặc trưng trong hợp chất là +3. D. Có 3 electron ở lớp ngoài cùng.
Câu 9. Sản phẩm của phản ứng nhiệt nhôm luôn có
A. Al. B. Al(OH)3. C. Al2O3. D. O2.
Câu 10. Cấu hình electron nào sau đây là của Fe?
A. [Ar] 4s23d6. B. [Ar]3d64s2. C. [Ar]3d8. D. [Ar]3d74s1.
Câu 11. Tính chất vật lý nào sau đây của sắt khác với các đơn chất kim loại khác?
A. Tính dẻo, dễ rèn. B. Có tính nhiễm từ. C. Dẫn điện và nhiệt tốt. D. Là kim loại nặng.
Câu 12. Phát biểu nào không đúng?
A. Gang là hợp chất Fe-C. B. Hàm lượng C trong gang nhiều hơn trong thép.
C. Gang là hợp kim Fe-C và 1 số nguyên tố khác. D. Gang trắng chứa ít C hơn gang xám.
Câu 13. Sắt(III) oxit có công thức hóa học là
A. Fe2O3. B. FeO. C. Fe3O4. D. Fe(OH)2.
Câu 14. Oxit lưỡng tính là
A. Cr2O3. B. MgO. C. CrO. D. CaO.
Câu 15. Các số oxi hoá đặc trưng của crom trong hợp chất là:
A. +2, +4, +6. B. +2, +3, +6. C. +1, +2, +4, +6. D. +3, +4, +6.
Câu 16. Chất khí nào sau đây là một trong các nguyên nhân gây ra hiệu ứng nhà kính?
A. SO2. B. CO2. C. NH3. D. N2.
Câu 17. Khi điều chế kim loại các ion kim loại đóng vai trò là chất
A. cho electron. B. bị khử. C. nhận proton. D. bị oxi hoá.
Câu 18. Kim loại kiềm có nhiệt độ nóng chảy thấp là do
A. khối lượng riêng nhỏ. B. tính khử của kim loại mạnh.
C. bán kính nguyên tử lớn. D. lực liên kết kim loại trong mạng tinh thể kém bền.
Câu 19. Trong các kim loại kiềm thổ: Mg, Ca, Sr, Ba. Kim loại có tính khử mạnh nhất là
A. Sr. B. Ca. C. Ba. D. Mg.
Câu 20. Sục 6,72 lít khí CO2 (đktc) vào dung dịch Ca(OH)2 dư. Kết thúc phản ứng khối lượng kết tủa thu được là
A. 15 gam. B. 25 gam. C. 20 gam. D. 30 gam.
Câu 21. Nhôm hiđroxit không phản ứng được với chất nào sau đây?
A. Dung dịch KOH. B. Dung dịch H2SO4. C. Dung dịch H2SO4 đặc nguội. D. Dung dịch NH3¬.
Câu 22. Cho các chất: Al, Al2O3, AlCl3, Al(OH)3. Số chất phản ứng được với dung dịch HCl là
A. 2. B. 3. C. 1. D. 4.
Câu 23. Cho Fe dư vào dung dịch H2SO4 loãng thu được 6,72 lít khí (ở điều kiện tiêu chuẩn). Khối lượng Fe tham gia phản ứng là
A. 16,8 gam. B. 5,6 gam. C. 25,2 gam. D. 11,2 gam.
Câu 24. Dãy gồm hai chất chỉ có tính oxi hoá là
A. Fe(NO3)2, FeCl3. B. Fe(OH)2, FeO. C. Fe2O3, Fe2(SO4)3. D. FeO, Fe2O3.
Câu 25. Chất rắn màu lục, tan trong dung dịch HCl được dung dịch A. Cho A tác dụng với NaOH và brom được dung dịch màu vàng, thêm tiếp H2SO4 vào thì thu được dung dịch có màu da cam. Chất rắn đó là
A. Cr2O3. B. CrO. C. CrO3. D. Cr.
Câu 26. Cho các phát biểu sau:
(1) Lưu huỳnh, photpho, cacbon đều phản ứng với CrO3;
(2) Bột nhôm dễ phản ứng với khí Cl2;
(3) Phèn chua có công thức là KAl(SO4)2.12H2O;
(4) Cr2O3 là oxit lưỡng tính.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
Câu 27. Ứng dụng nào sau đây không đúng?
A. Khi nghiền clanhke, trộn thêm thạch cao để điều chỉnh tốc độ đông cứng của xi măng.
B. Đá vôi được dùng làm vật liệu xây dựng, sản xuất vôi, xi măng, …
C. Khi nung nóng, thạch cao sống bị mất nước tạo thành thạch nhũ trong các hang động.
D. Vôi tôi được sử dụng rộng rãi trong công nghiệp và nông nghiệp.
Câu 28. Trường hợp nào sau đây thu được kết tủa sau khi phản ứng xảy ra hoàn toàn?
A. Sục khí CO2 dư vào dung dịch Ca(OH)2.
B. Cho dung dịch NaOH dư vào dung dịch HCl.
C. Cho dung dịch Na3PO4 vào dung dịch Ca(HCO3)2.
D. Cho CaCO3 vào dung dịch HCl loãng, dư.
PHẦN TỰ LUẬN.
Câu 29 (1 điểm): Cho m gam hỗn hợp X gồm Al, Cr tác dụng với lượng dư dung dịch HCl loãng nóng dư không có không khí, thu được 1,456 lít khí H2 (ở đktc). Cũng m gam hỗn hợp X tác dụng với lượng dư dung dịch NaOH đặc thu được 1,008 lít khí H2 (ở đktc).
a) Viết phương trình hóa học của các phản ứng xảy ra?
b) Tính m?
Câu 30 (1 điểm): Hoàn thành sơ đồ chuyển hóa sau:
Ca(OH)2 NaOH Fe(OH)3¬ Fe2O3 Al2O3
Câu 31 (0,5 điểm):Cho các dung dịch đựng riêng biệt trong các lọ mất nhãn sau: NH4Cl, NaCl, BaCl2, Na2CO3. Chỉ dùng thêm một thuốc thử, trình bày cách nhận biết 4 chất trên? Viết các phương trình hóa học của các phản ứng xảy ra(nếu có)?
Câu 32 (0,5 điểm): Hoà tan 5 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ thu được 0,56 lít khí H2 ở đktc và dung dịch A.
a) Tính % khối lượng mỗi chất trong hỗn hợp ban đầu?
b) Cho dung dich A tác dụng với dung dịch NaOH dư. Lấy kết tủa nung trong không khí đến khối lượng không đổi được m gam chất rắn X.(Biết hiệu suất các phản ứng là 100%). Tính m?
ĐỀ THAM KHẢO HÓA 12
ĐỀ THAM KHẢO KIỂM TRA HỌC KỲ 2
Môn: Hoá học - Lớp 12
Thời gian: 45 phút
ĐỀ THAM KHẢO SỐ 1
I–Trắc nghiệm
Câu 1. Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là:
A. ns2np3 B. ns2np4 C. ns2np5 D. ns2np6
Câu 2. Chất X là chất khí ở điều kiện thường, có màu vàng lục, dùng để khử trùng nước sinh hoạt… Chất X là: A. O2 B. Cl2 C. SO2 D. O3
Câu 3. Cho 15,8 gam KMnO4 tác dụng hoàn toàn với HCl đặc, dư. Thể tích khí thu được ở (đktc) là:
A. 5,6 lít B.3,36 lít C. 2,24 lít D. 1,12 lít
Câu 4. Cho lần lượt các chất sau: Cu, C, MgO, KBr, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3 tác dụng với dung dịch H2SO4 đặc, nóng. Số phản ứng oxi hoá - khử là:
A. 9 B. 8 C. 7 D. 6
Câu 5. Thuốc thử có thể dùng để phân biệt được cả 4 lọ KF, KCl, KBr, KI là
A. AgNO3 B. NaOH C. quỳ tím D. Cu
Câu 6. Có 3 bình đựng 3 chất khí riêng biệt: O2, O3, H2S lần lượt cho từng khí này qua dung dịch KI có pha thêm hồ tinh bột, chất khí làm dung dịch chuyển màu xanh là :
A. O2 B. H2S C. O3 D. O3 và O2
Câu 7. Có 4 dd sau đây: HCl , Na2SO4 , NaCl , Ba(OH)2 . Chỉ dùng thêm 1 hóa chất nào sau đây để phân biệt được 4 chất trên?
A. Na2SO4. B. Phenolphtalein. C. dd AgNO3 . D. Quỳ tím
Câu 8. Cu kim loại có thể tác dụng với chất nào trong các chất sau?
A. Khí Cl2. B. Dung dịch HCl. C. Dung dịch KOH đặc D. Dung dịch H2SO4 loãng.
Câu 9. Dẫn khí clo qua dung dịch NaOH ở nhiệt độ phòng, muối thu được là:
A. NaCl, NaClO3 B. NaCl, NaClO C. NaCl, NaClO4 D. NaClO, NaClO3
Câu 10. Dãy chất nào sau đây vừa có tính oxi hoá, vừa có tính khử?
A. O2 , Cl2 , H2S. B. S, SO2 , Cl2 C. F2, S , SO3 D. Cl2 , SO2¬, H2SO4
Câu 11. Dãy chất tác dụng được với dung dịch H2SO4 đặc nguội là:
A. CaCO3, Al, CuO B. Cu, MgO, Fe(OH)3 C. S, Fe, KOH D. CaCO3, Au, NaOH
Câu 12. Dung dịch axit HCl tác dụng được với dãy chất nào sau đây:
A. Zn, CuO, S. B. Fe, Au, MgO C. CuO, Mg, CaCO3 D. CaO, Ag, Fe(OH)2
Câu 13. Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng:
A. Xuất hiện chất rắn màu đen B. Chuyển sang màu nâu đỏ
C. Vẫn trong suốt, không màu D. Bị vẩn đục, màu vàng.
Câu 14. Hấp thụ 6,72 lít khí SO2 (đktc) vào 250 ml dung dịch NaOH 2M. Dung dịch sau phản ứng chứa:
A. NaHSO3 1,2M. B. Na2SO3 1M .
C. NaHSO3 0,4M và Na2SO3, 0,8M. D. NaHSO3 0,5M và Na2SO3, 1M.
Câu 15. Hòa tan 10,8 gam một kim loại R có hóa trị không đổi vào dung dịch HCl loãng dư thu được 10,08 lít H2 (ở đktc). Kim loại R là:
A. Mg B. Fe C. Zn D. Al
Câu 16. Hòa tan hết m gam hỗn hợp CuO, MgO, Fe2O3 vào 400 ml dung dịch axit HCl 3M vừa đủ. Cô cạn dung dịch sau phản ứng thu được 65 gam muối khan. Tính m?
A. 22,4 g B. 32,0 g C. 21,2 g D. 30,2 g
Câu 17. Oxi hóa 16,8 gam sắt bằng V lít không khí (ở đktc) thu được m gam chất rắn A gồm (Fe, FeO, Fe2O3, Fe3O4). Hòa tan hết A bằng dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 sản phẩm khử duy nhất. Tính V (Biết các khí đo ở đktc và O2 chiếm 1/5 thể tích không khí).
A. 33,6 lit B. 11,2 lít C. 2,24 lít D. 44,8 lít
Câu 18. Phương pháp để điều chế khí O2 trong phòng thí nghiệm là:
A. Điện phân H2O B. Chưng cất phân đoạn không khí lỏng
C. Nhiệt phân KMnO4 D. Điện phân dung dịch NaCl
Câu 19. Thuốc thử để phân biệt 2 bình đựng khí H2S, O2 là:
A. Dd HCl B. Dd KOH C. Dd NaCl D. Dd Pb(NO3)2
Câu 20. Trộn 100 ml dung dịch H2SO4 2M và 208g dung dịch BaCl2 15% thì khối lượng kết tủa thu được là:
A. 58,25g B. 23,30g C. 46,60g D. 34,95g.
ĐỀ THAM KHẢO SỐ 2
Câu 1: Muốn pha loãng dung dịch axit H2SO4 đặc cần phải:
A. Rót từ từ nước vào dung dịch axit đặc. B. Rót từ từ dung dịch axit đặc vào nước
C. Rót nhanh dung dịch axit vào nước D. Rót nước thật nhanh vào dung dịch axit đặc
Câu 2: Cho các yếu tố sau:
a. áp suất b. xúc tác c. nồng độ chất. d. nhiệt độ e. diện tích tiếp xúc.
Những yếu tố ảnh hưởng đến tốc độ phản ứng nói chung là:
A.a, b, c, d. B. b, c, d, e. C. a, c, e. D. a, b, c, d, e.
Câu 3: Trong phòng thí nghiệm, người ta thường điều chế khí Clo bằng cách:
A. Điện phân dung dịch NaCl có màng ngăn B. Điện phân nóng chảy NaCl
C. Cho F2 đẩy Cl2 khỏi dung dịch NaCl D. Cho dung dịch HCl đặc tác dụng với MnO2
Câu 4: Lưu huỳnh có các mức oxi hóa là
A. -2, 0, +4, +6 B. -1; 0; +1; +3; +5; +7 C. +1; +3; +5; +7 D. -2; 0; +6; +7
Câu 5: Cho phản ứng hóa học SO2 + Br2 + H2O → HBr + H2SO4. Hệ số cân bằng của phản ứng trên lần lượt là?A. 2,1,2,1,2 B. 2,2,1,1,2 C. 1,1,2,2,1 D. 1,2,1,2,1
Câu 6: Thuốc thử có thể dùng để phân biệt được cả 4 lọ KF, KCl, KBr, KI là
A. AgNO3 B. NaOH C. quỳ tím D. Cu
Câu 7: Nước Gia-ven được điều chế bằng cách
A. Cho clo tác dụng với nước B. Cho clo sục vào dung dịch NaOH
C. Cho clo sục vào dung dịch KOH đặc nóng D. Cho clo tác dụng với Ca(OH)2
Câu 8: Nước clo hoặc khí clo ẩm có tính tẩy màu (tẩy trắng) vì nguyên nhân là :
A. Clo hấp thụ màu B. Nước clo chứa HClO có tính oxi hóa mạnh, tẩy màu
C. Clo tác dụng với nước tạo ra HCl có tính tẩy màu D. Tất cả đều đúng
Câu 9: Để phân biệt được 3 chất khí : CO2, SO2 và O2 đựng trong 3 bình mất nhãn riêng biệt , người ta dùng thuốc thử là:
A. Dung dịch Br2 B. Nước vôi trong (dd Ca(OH)2) và dung dịch Br2
C. Nước vôi trong (dd Ca(OH)2) D. Dung dịch KMnO4
Câu 10: Cho 16,25 gam một kim loại M hoá trị II tác dụng vừa đủ với 250ml dung dịch HCl 2M. Kim loại M là:A. Al B. Cu C. Zn D. Mg
Câu 11: Kim loại nào dưới đây có phản ứng với axit H2SO4 đặc, nguội?
A. Fe B. Al C. Zn D. Cr
Câu 12: Cho các chất: O2, S, SO2, H2S, H2SO4. Có bao nhiêu chất vừa có tính oxi hóa, vừa có tính khử?
A. 4. B. 2. C. 1. D. 3.
Câu 13: Đổ dung dịch chứa 1 gam HCl vào dung dịch chứa 1 gam NaOH. Nhúng quỳ tím vào dung dịch thu được thì quỳ tím chuyển sang màu nào?
A. Màu xanh B. Màu đỏ C. Màu tím D. Màu vàng
Câu 14: Cấu hình electron lớp ngoài cùng của lưu huỳnh là :
A. 3s23p4 B. 3s23p6 C. 3s23p3 D. 2s22p4
Câu 15: Tầng ozon có khả năng ngăn tia cực tím từ vũ trụ thâm nhập vào trái đất vì
A. Tầng ozon có khả năng phản xạ ánh sáng tím.
B. Tầng ozon đã hấp thụ tia cực tím cho cân bằng chuyển hóa ozon và oxi.
C. Tầng ozon rất dày, ngăn không cho tia cực tím đi qua.
D. Tầng ozon chứa khí CFC có tác dụng hấp thụ tia cực tím.
Câu 16: Cho hệ cân bằng sau được thực hiện trong bình kín : 2SO2(k) + O2(k) 2SO3 (k), H < 0
Yếu tố nào sau đây giúp làm tăng hiệu suất tổng hợp SO3?
A. Giảm nhiệt độ, tăng áp suất B. Tăng nhiệt độ, giảm áp suất
C. Tăng nhiệt độ, tăng áp suất D. Giảm nhiệt độ, giảm áp suất
Câu 17: Cho các phương trình hóa học sau:
(1) F2 + H2O → HF + HFO (2) 2KBr + I2 → 2KI + Br2
(3) NaF + AgNO3 → AgF + NaNO3 (4) Cl2+ 2FeCl2→ 2FeCl3
Số phương trình hóa học không đúng là: A. 4 B. 3 C. 2 D. 1
Câu 18: Cho 2,8 g 1 kim loại R bằng H2SO4 đặc nóng thu được 1,68 lít khí SO2 (đktc) sản phẩm khử duy nhất. R là:A. Cu B. Al C. Fe D. Ag
Câu 19: Kim loại Cu không phản ứng được với chất nào sau đây:
A. H2SO4 loãng B. H2SO4 đặc C. O2 D. Cl2
Câu 20: Trong các chất sau, chất nào chỉ có tính khử?
A. S. B. SO2. C. H2S. D. H2SO4.
ĐỀ THAM KHẢO SỐ 3
Câu 1: Dẫn khí X đến dư qua dung dịch brom, thấy dung dịch brom bị mất màu. Khí X có thể là
A. SO3. B. CO2. C. SO2. D. Cl2.
Câu 2: Hấp thụ hoàn toàn 2,24 lit khí SO2 (đktc) vào dung dịch chứa 0,2 mol NaOH. Sau phản ứng thu được dung dịch chứa muối
A. NaHSO3. B. Na2S. C. Na2SO3. D. Na2SO4.
Câu 3: Nhiệt phân hoàn toàn 30,02 gam KMnO4 với hiệu suất là 75%, thể tích O2 (đktc) thu được là
A. 2,128 lít. B. 2,837 lít. C. 1,596 lít. D. 2,576 lít.
Câu 4: Cho m gam Cu tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng (dư) thu được 6,72 lít khí SO2 (ở đktc, sản phẩm khử duy nhất). Giá trị của m là
A. 9,6. B. 4,8. C. 1,92. D. 19,2.
Câu 5: Một mẫu khí thải công nghiệp có nhiễm các khí H2S, CO, CO2. Để nhận biết sự có mặt của H2S trong mẫu khí thải đó, ta dùng dung dịch
A. NaOH. B. Pb(NO3)2. C. Ca(OH)2. D. NaNO3.
Câu 6: Cho 20 gam hỗn hợp KHCO3 và CaCO3 vào dung dịch HCl dư, sau khi phản ứng hoàn toàn thu được V lit khí (đktc). Giá trị của V là
A. 4,48. B. 1,12. C. 2,24. D. 3,36.
Câu 7: Hòa tan hoàn toàn 14,40 gam kim loại M (hóa trị II) trong dung dịch HCl loãng (dư) thu được 13,44 lít khí H2 (đktc). Kim loại M làA. Mg. B. Ca. C. Ba. D. F.
Câu 8: Hòa tan hoàn toàn 6,1 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 2,24 lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 31,80. B. 31,40. C. 15,7. D. 8,98.
Câu 9: Dùng bông tẩm dung dịch axit sunfuric rồi viết lên tờ giấy trắng, sau đó hơ nóng trên ngọn lửa đèn cồn thì thấy nét chữ xuất hiện màu đen do dung dịch axit sunfuric đặc có tính háo nước. Axit sunfuric có công thức phân tử làA. HCl. B. H2S. C. Na2SO4. D. H2SO4.
Câu 10: Kim loại nào sau đây phản ứng được với dung dịch H2SO4 đặc nguội?
A. Au. B. Cu. C. Fe. D. Al.
Câu 11: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là:
A. Ag,Mg,Pb,Fe. B. Cu,Zn,Au,Pt C. Cu,Zn,Ca,Al D. Mg,Na,Fe,Al
Câu 12: Phản ứng nào không xảy ra được giữa các cặp chất sau?
A. Ba(NO3)2 và Na2SO4B. AgNO3 và NaCl C. Cu(NO3)2 và NaOH D. KNO3 và NaCl
Câu 13: Phản ứng tổng hợp NH3 theo phương trình hóa học N2 + 3 H2 2NH3 ; .
Để cân bằng chuyển dời theo chiều thuận cần:
A. giảm nhiệt độ B. A và C C. tăng nhiệt độ D. tăng áp suất
Câu 14: Cho 14.7g axit sunfuric loãng tác dụng với Fe dư. Tính thể tích khí bay ra vào cho biết tên chất khí.
A. 1,68 lít H¬2 B. 3,36 lít H2 C. 3,36 lít SO2 D. 1,68 lít SO2
Câu 15: Cho 15,8 gam KMnO4 tác dụng hoàn toàn với HCl đặc, dư. Thể tích khí thu được ở (đktc) là:
A. 3,36 lít B. 1,12 lít C. 5,6 lít D. 2,24 lít
Câu 16: Tính oxi hoá của các halogen được sắp xếp như sau:
A. Cl2 > F2 > Br2 > I2 B. I2> Br2 >Cl2 > F2 C. F2 >Cl2 > Br2 > I2 D. Br2 > F2> I2 >Cl2
Câu 17: Đặc điểm chung của các nguyên tố halogen là:
A. vừa có tính oxi hóa, vừa có tính khử B. có tính oxi hóa mạnh
C. Ở điều kiện thường là chất khí D. tác dụng mạnh với nước
Câu 18: Hơi thủy ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là:A. Cát B. Muối ăn C. Lưu huỳnh D. Vôi sống
Câu 19: Cho 16 gam hỗn hợp bột Fe và Mg tác dụng với dung dịch HCl dư thấy có 1 gam khí H2 bay ra. Khối luợng muối tạo ra trong dung dịch là:
A. 51,5 gam. B. 33,75 gam. C. 87 gam. D. 52,5 gam.
Câu 20: Cho 18,2 gam hỗn hợp 2 kim loại Cu và Al vào dung dịch HCl thu được 6,72 lít khí H2 (đktc), dung dịch X và chất rắn không tan B. Cho B phản ứng với H2SO4 đặc thu 4,48 lít khí SO2 (đktc). Khối lượng mỗi kim loại trong hỗn hợp ban đầu lần lượt là:
A. 12,8 gam Cu và 11,8 gam Al B. 6,4 gam Cu và 5,4 gam Al
C. 6,4 gam Cu và 11,8 gam Al D. 12,8 gam Cu và 5,4 gam Al
B. BÀI TẬP TỰ LUẬN
Câu 1: Thực hiện các dãy chuyển hóa sau, ghi rõ điều kiện phản ứng (nếu có):
a) NaCl → Cl2 → HCl → NaCl → HCl → Cl2 → Br2 → I2 → AlI3
b)FeS2 SO2 S SO2 SO3 H2SO4 FeSO4 FeCl3 Fe(NO3¬)3
c) KClO3 O2 SO2 H2SO4 CuSO4 Fe2(SO4)3 BaSO4
Câu 2: Nêu hiện tượng và viết ptpư khi:
a) Cho dd Na2¬S vào dd Pb(NO3)2. b) Để lâu lọ chứa dd H2S mở nắp lâu ngày.
c) Sục khí SO2¬ vào dd nước Br2. d) Cho H2SO4 đặc vào cốc chứa đường saccarozơ.
Câu 3: Viết phương trình hóa học chứng minh
a) Cl2 vừa có tính khử vừa có tính oxi hóa.
c) Tính oxi hóa của Br2 > I2.
d) Tính oxi hóa của O3 mạnh hơn O2.
Khí SO2¬ làm mất màu dd nước Br2.
Câu 4: Hòa tan 8,3 gam hỗn hợp gồm Al và Fe trong dung dịch HCl dư thu được 5,6 lít khí H¬2 (đkc) và dung dịch A.
a)Tính % khối lượng mỗi kim loại có trong hỗn hợp ban đầu ?
b)Tính thể tích dd HCl 2M ban đầu, biết người ta dùng dư 10% so với lí thuyết.
c)Tính nồng độ mol/lit của các chất có trong dung dịch A?
Câu 5: Hỗn hợp X gồm 11,2 gam Fe và 7,2 gam FeO. Cho toàn bộ hỗn hợp X tác dụng dung dịch H2SO4 loãng dư thu được dung dịch Y và V1 lít khí (đktc). Cô cạn dung dịch Y thu được m gam muối khan.
a) Tính m và V1.
b) Nếu cho toàn bộ hỗn hợp X ở trên tác dụng với dung dịch H2SO4 đặc, nóng dư thu được V2 lít khí SO2 (đktc, sản phẩm khử duy nhất). Tính V2.
Câu 6: Đun nóng hỗn hợp gồm 6,72 gam Fe và 3,2 gam S trong điều kiện không có không khí đến khi phản ứng hoàn toàn thu được chất X. Cho X tác dụng với dung dịch H2SO4 đặc nóng dư thu được V lít khí SO2 (đktc, sản phẩm khử duy nhất).
a) X chứa chất gì? Khối lượng bằng bao nhiều?
b) Tính V?
Câu 7: Cho m gam hỗn hợp X gồm Fe và Cu. Chia hỗn hợp X thành 2 phần bằng nhau.
Phần 1: cho tác dụng với dung dịch H2SO4 loãng, dư thu được 1,12 lít khí (đktc)
Phần 2: cho tác dụng vừa đủ với V lít dung dịch H2SO4 đặc, nguội (98% ,D= 1,84g/ml) thu được 4,1216 lít khí (đktc)
a, Tính m và phần trăm theo khối lượng mỗi kim loại trong X
b, Tính V
Câu 8: Cho cân bằng hoá học: N2(k) + 3H2(k) 2NH3(k) ∆H <0.
Cân bằng trên chuyển dịch theo chiều nào khi:
a) Thêm vào một lượng H2.
b) Tăng áp suất của hệ.
c) Tăng nhiệt độ của hệ.
Câu 9: Cân bằng hóa học sau được thiết lập trong bình kín:
2SO2(k) + O2(k) 2SO3(k) ∆H <0
Cân bằng phản ứng sẽ chuyển dịch về phía nào khi:
a. Thêm một lượng oxi vào hệ b. Giảm nhiệt độ của hệ c. Tăng áp suất của hệ.
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
II–Tự luận (5,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
a. Fe + Cl2 ……………………………………………………………………………………………
b. Ba(NO3)2 + MgSO4 …………………………………………………………………………………….
c. HCl + Mg(OH)2 ……………………………………………………………………………………….
d. P + H2SO4 đặc, nóng …………………………………………………………………………………
e. Al + H2SO4 đặc, nóng SO2 + H2S + ..... ……………………………………………………
(biết tỉ lệ mol SO2 và H2S là 1 : 3)
Bài 2. (2,5 điểm)
Hòa tan 22,8 gam hỗn hợp X gồm Mg và Fe vào dung dịch H2SO4 98% (đặc, nóng, dư). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và thu được dung dịch Y.
a. Tính thành phần % khối lượng mỗi kim loại trong X. (1,5 điểm)
b. Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 400 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO4 98% ban đầu. (0,5 điểm)
c. Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 2:1) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng. (0,5 điểm)
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
ĐỀ THAM KHẢO HÓA 11
A. PHẦN TRẮC NGHIỆM KHÁCH QUAN (7 điểm)
Câu 1: Etan có công thức phân tử là
A. C3H6. B. C3H8. C. C2H4. D. C2H6.
Câu 2: Chất nào sau đây là đồng phân của but – 2 – en?
A. But – 1 – en. B. But – 2 – in. C. But – 1 – in. D. Buta – 1,3 – đien.
Câu 3: Số liên kết đôi C=C trong phân tử isopren là
A. 2. B. 3. C. 4. D. 1.
Câu 4: Dãy đồng đẳng của benzen có công thức phân tử chung là
A. CnH2n + 2 với (n 1). B. CnH2n với (n 2). C. CnH2n – 2 với (n 3). D. CnH2n – 6 với (n 6).
Câu 5: Chất nào sau đây không làm mất màu dung dịch thuốc tím (KMnO4) ngay cả khi đun nóng?
A. Toluen B. Stiren C. Benzen D. Hexen
Câu 6: Ở điều kiện thường chất nào sau đây là chất lỏng?
A. Metan. B. Bezen. C. Etilen. D. Axetilen.
Câu 7: Tên thay thế của CH3OH là
A. etanol. B. metanol. C. propanol. D. ancol etylic.
Câu 8: Ancol etylic không tác dụng với chất nào sau đây?
A.Na. B. CuO (đun nóng). C. axit HBr (đun nóng). D. NaOH.
Câu 9: Glixerol có số nhóm hiđroxyl (-OH) trong phân tử là
A. 1. B. 2. C. 3 . D. 4.
Câu 10: Phenol không phản ứng với chất nào sau đây ?
A. Na. B. NaOH. C. NaHCO3. D. Br2.
Câu 11: Phenol rất độc, do đó khi sử dụng phenol phải hết sức cẩn thận. Công thức cấu tạo của phenol là
A. C6H5OH. B. C6H5CH2OH. C. C6H5CH3. D. C2H5OH.
Câu 12: Dung dịch nước của fomanđehit (fomon) được dùng làm chất tẩy uế, ngâm mẫu động vật làm tiêu bản, …. Công thức cấu tạo của fomanđehit là
A. HCHO. B. CH3CHO. C. C2H5CHO. D. (CH3)2CHCHO.
Câu 13:Chất nào sau đây tham gia phản ứng tráng bạc?
A. CH3OH. B. CH3CHO. C. C6H5OH. D. CH3COOH.
Câu 14: Anđehit axetic được điều chế trực tiếp từ chất nào sau đây?
A. metanol. B. propanol. C. etanol. D. phenol .
Câu 15: Công thức cấu tạo thu gọn của axit axetic là
A. CH3OH. B. CH3CHO. C. C6H5OH. D. CH3COOH.
Câu 16: Chất nào sau đây có nhiệt độ sôi cao nhất?
A. Axit fomic. B.Axit axetic . C. Etanal. D. Etan.
Câu 17: Đốt cháy hoàn toàn 0,015 mol C3H8, thu được H2O và m gam CO2. Giá trị của m là
A. 1,98. B. 0,54. C. 0,66. D.0,18 .
Câu 18: Chất nào sau đây là sản phẩm chính khi hiđrat hóa but – 1 – en?
A.CH3CH2CH(OH)CH3. B. CH3CH2CH2CH2OH. C. CH3CH2CH2CH3. D. CH3CH2CH2CH2Cl.
Câu 19: Phát biểu nào sau đây đúng?
A. Các hiđrocacbon thơm có nhiệt độ sôi tăng theo chiều tăng của phân tử khối.
B. Công thức phân tử của benzen là C8H8.
C. Toluen không làm mất màu dung dịch KMnO4 khi đun nóng.
D. Công thức phân tử chung dãy đồng đẳng của benzen là CnH2n-2 (n ).
Câu 20: Toluen tác dụng với Br2 ( t0) theo tỉ lệ mol 1:1, thu được chất hữu cơ X. Công thức cấu tạo thu gọn của X là
A.C6H5CH2Br . B. C6H5Br. C. CH3C6H4Br. D.C6H5CHBrCH2Br .
Câu 21: Cho a mol ancol CH3OH tác dụng hoàn toàn với kim loại Na dư, thu được 4,48 lít khí H2 (ở đktc). Giá trị của a là
A. 0,2. B. 0,6 . C. 0,4. D. 0,1.
Câu 22: Đun etanol với H2SO4 đặc ở 1800C, thu được chất nào sau đây?
A. Propen. B. Eten. C. Propan. D. Etan.
Câu 23: Chọn phát biểu sai:
A. Phenol có tính axit nhưng yếu hơn axit cacbonic.
B. Giữa nhóm -OH và vòng benzen trong phân tử phenol không có ảnh hưởng qua lại với nhau.
C. Phenol tác dụng được với natrihidroxit tạo thành muối và nước.
D. Dung dịch phenol không làm đổi màu quỳ tím vì tính axit của phenol rất yếu.
Câu 24: Cả phenol và ancol etylic đều phản ứng được với
A. Na B. NaOH C. Br2 D. NaHCO3.
Câu 25: Cho m gam CH3CHO tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 3,24 gam Ag. Giá trị của m là
A. 0,88. B. 0,44. C.1,32 . D. 0,66.
Câu 26: Hiđro hóa hoàn toàn metanal (xúc tác Ni,to), thu được sản phẩm là
A. axit axetic. B. ancol etylic. C. metanol. D. etilen.
Câu 27: Nhỏ dung dịch chất nào sau đây vào đá vôi, thấy có khí CO2 thoát ra?
A. Phenol. B. Axit axetic. C. Metanol. D. Propanal.
Câu 28: Để phân biệt ba dung dịch: dung dịch etanol, dung dịch glixerol và dung dịch phenol, ta lần lượt dùng các hóa chất nào sau đây ?
A. Na, nước Br2. B. NaOH, Na C. nước Br2, Cu(OH)2 D. nước Br2, Na.
B.PHẦN TỰ LUẬN (3 điểm)
Câu 29 (1 điểm). Hoàn thành các phương trình hóa học sau
a) C6H5OH + NaOH b) CH3COOH + Na2CO3
c) C2H5OH + O2(dư) d) CH2=CH2 + HCl
Câu 30 (1 điểm). X là ancol no, đơn chức mạch hở. Cho 3,6 gam X tác dụng với Na dư thu được 0,672 lít H2 (ở đktc). Viết công thức cấu tạo và gọi tên của X.
Câu 31 (0,5 điểm). Chia m gam hỗn hợp A gồm axit axetic và ancol etylic thành 2 phần bằng nhau.
Phần 1: tác dụng hết với Na dư thu được 2,24 lit khí H2 (đktc).
Phần 2: trung hòa vừa đủ với 150 ml dd NaOH 1M.
Tính m?
Câu 32 (0,5 điểm). Hợp chất hữu cơ X (phân tử có vòng benzen) có CTPT là C7H8O2 , tác dụng được với Na và với NaOH. Biết:
- Khi cho a mol X tác dụng với Na dư thì thu được a mol khí H2.
- a mol X tác dụng vừa đủ với a mol dung dịch NaOH.
Xác định công thức cấu tạo thu gọn của X?
(Cho Ag= 108, C=12, H=1,O=16)
................HẾT.................
ĐỀ SỐ 2
(Biết C = 12; H = 1; O = 16; N = 14; Ag = 108; Na = 23; K = 39; Br = 80)
I. PHẦN TRÁC NGHIỆM (7 điểm)
Câu 1. Trong số các chất sau chất nào tác dụng được với dung dịch AgNO3 trong NH3 tạo kết tủa vàng?
A. B. CH3-CH=CH2 C. CH3-CH2-CH3 D. CH3-CH3
Câu 2. Dãy đồng đẳng anken có công thức phân tử chung là
A. CnH2n-2(n 2) B. CnH2n+2(n 1) C. CnH2n+1 (n 1) D. CnH2n(n 2)
Câu 3. Hiện nay nhiều nơi ở nông thôn đang sử dụng hầm biogas để xử lí chất thải trong chăn nuôi gia súc, cung cấp nhiên liệu cho việc đun nấu. Thành phần chính trong khí biogas là khí metan. Khí metan có công thức phân tử là
A. C3H6 B. C2H4 C. CH4 D. C2H2
Câu 4. Theo danh pháp IUPAC, hợp chất CH3-CH2-COOH có tên gọi là
A. Axit pentannoic B. Axit butanoic C. Axit propanoic D. Axit metanoic
Câu 5. Dẫn V lít (ở đktc) hỗn hợp X gồm axetilen và hiđro đi qua ống sứ đựng bột niken nung nóng, thu được khí Y. Dẫn Y vào lượng dư AgNO3 trong dung dịch NH3thu được 12 gam kết tủA. Khí đi ra khỏi dung dịch phản ứng vừa đủ với 16 gam brom và còn lại khí Z. Đốt cháy hoàn toàn khí Z thu được 2,24 lít khí CO2(ở đktc) và 4,5 gam nước. Giá trị của V bằng?
A. 11,2 lít B. 5,60 lít C. 8,96 lít D. 13,44 lít
Câu 6. Ancol là những hợp chất hữu cơ trong phân tử có nhóm…(1)….liên kết trực tiếp với….(2)…….. Điền cụm từ thích hợp vào (1) và (2).
A. , nguyên tử cacbon hoặc nguyên tử hiđro
B. –COOH (cacboxyl), nguyên tử cacbon hoặc nguyên tử hiđro
C. –OH (hiđroxyl), nguyên tử cacbon no
D. –CH=O, nguyên tử cacbon hoặc nguyên tử hiđro
Câu 7. Hóa hơi 8,64 gam hỗn hợp gồm một axit no, đơn chức, mạch hở X và một axit no, đa chức Y (có mạch cacbon hở, không phân nhánh) thu được một thể tích hơi bằng thể tích của 2,8 gam N2 (đo trong cùng điều kiện nhiệt độ, áp suất). Đốt cháy hoàn toàn 8,64 gam hỗn hợp hai axit trên thu được 11,44 gam CO2. Tính phần trăm khối lượng của X trong hỗn hợp ban đầu.
A. 72,22 % B. 35,25 % C. 65,15 % D. 27,78 %
Câu 8. Khi cho CH3-CH2-CH3 tác dụng với Cl2 (ánh sáng, tỉ lệ mol 1:1). Số sản phẩm monoclo tối đa thu được là
A. 1 B. 2 C. 4 D. 3
Câu 9. Nhóm chức của anđehit là
A. -NH2 B. -COOH C. -CHO D. -OH
Câu 10. Cho 4,6 gam glixerol tác dụng hết với V ml dung dịch HCl 1M. Giá trị của V bằng?
A. 250ml B. 300 ml C. 150ml D. 200ml
Câu 11. Giấm là một chất lỏng có vị chua, được hình thành nhờ sợ lên men của ancol etylic. Thành phần chính của giấm là axit axetic có nồng độ từ 2% đến 5%. Axit axetic có công thức?
A. C2H5OH B. CH3COOH C. CH3OH D. HCHO
Câu 12. Trước kia thuốc trừ sâu 666 được sử dụng rộng rãi trong nền nông nghiệp nhưng do chất này có độc tính cao và phân hủy chậm nên đã bị cấm sử dụng tại 169 quốc gia tham gia công ước Stockholm. Chất được sử dụng làm thuốc trừ sâu 666 có công thức là
A. C2H2 B. C6H6Cl6 C. C4H6 D. C3H8
Câu 13. Cho phản ứng:
Xác định vai trò của CH3CHO trong phản ứng trên
A. Chất khử B. Axit C. Chất oxi hóa D. Bazơ
Câu 14. Để trung hòa hoàn toàn 6 gam axit axetic cần dùng V lít dung dịch NaOH 1M. Giá trị của V?
A. 0,05 lít B. 0,1 lít C. 0,2 lít D. 0,15 lít
Câu 15. Sản phẩm sinh ra trong thí nghiệm sau là gì?
A. CH3COOH B. (CH3CH2)2O C. CH3−CO−CH3 D. CH3CHO
Câu 16. Tính chất hóa học đặc trưng của ankan?
A. Phản ứng cộng B. Phản ứng trùng hợp
C. Phản ứng thế D. Phản ứng tách
Câu 17. Khí axetilen là nhiên liệu trong đèn xì oxi – axetilen đề hàn cắt kim loại vì phản ứng cháy của khí axetilen trong oxi tỏa ra lượng nhiệt rất lớn. Thể tích khí oxi (ở điều kiện tiêu chuẩn) cần để đốt cháy hết 1 mol khí axetilen là
A. 56 lít B. 112 lít C. 70 lít D. 65 lít
Câu 18. Dãy đồng đẳng của benzen (C6H6)có công thức phân tử chung là
A. CnH2n(n 2) B. CnH2n+2 (n 1)
C. CnH2n-6 (n 6) D. CnH2n-2 (n 2)
Câu 19. Phenol có công thức là
A. CH3OH B. CH3COOH C. C6H5OH D. C2H4
Câu 20. Ankađien là những hiđrocacbon mạch hở trong phân tử
A. Có 1 liên kết đôi C=C B. Chỉ có liên kết đơn
C. Có 2 liên kết đôi C=C D. Có 1 liên kết C C
Câu 21: Làm thí nghiệm như hình vẽ
Hiện tượng xảy ra trong ống nghiệm khi cho dư glixerol (C3H5(OH)3), lắc đều là gì?
A. Kết tủa tan, tạo dung dịch có màu xanh lam.
B. Không có hiện tượng gì.
C. Kết tủa vẫn còn, dung dich có màu trong suốt.
D. Kết tủa tan, dung dịch có màu nâu đỏ
Câu 22: Chất có công thức CH CH có tên gọi là
A. Etan. B. Metan. C. Etilen. D. Axetilen.
Câu 23: Đốt cháy hoàn toàn một ancol đơn chức (X) thu được 4,48 lít khí CO2 (đktc) và 4,5 gam H2O. Công thức của ancol (X) là
A. C3H7OH. B. C4H9OH. C. C2H5OH. D. CH3OH.
Câu 24: Thuốc thử để phân biệt hai khí but -2-in, but-1-in là
A. Dung dịch AgNO3 /NH3. B. Dung dịch KMnO4.
C. Dung dịch HCl. D. Dung dịch Br2.
Câu 25: Cho 0,94 gam phenol( C6H5OH) tác dụng vừa đủ với Vml dung dịch NaOH 1M. Giá trị của V là
A. 40ml B. 20ml C. 30ml D. 10ml
Câu 26: Dẫn 4,48 lít (đktc) hỗn hợp X gồm hai anken đồng đẳng kế tiếp qua bình đựng dung dịch brom dư thấy khối lượng bình sau phản ứng tăng thêm 7 gam. Biết các phản ứng xảy ra hoàn toàn. Công thức phân tử của 2 anken là
A. C4H8 và C5H10. B. C3H6 và C4H8.
C. C2H4 và C3H6. D. C5H10 và C6H12.
Câu 27: Metan là ankan có trong thành phần chính của khí thiên nhiên, khí biogas. Metan có công thức là
A. C2H6 B. C2H4 C. C2H2. D. CH4
Câu 28: Cho đốt cháy hết m gam hỗn hợp X các ancol trong dãy đồng đẳng thì thu được 11,2 lít khí CO2 ở đktc và 12,6 gam nước. Vậy m gam hỗn hợp X tác dụng với Na dư thì lượng khí H2 thoát ra là V lít(đktc). Giá trị lớn nhất của V là
A. 6,72. B. 2,24. C. 4,48. D. 3,36.
II. PHẦN TỤ LUẬN (3 ĐIỂM)
Câu 1: (1 điểm)
a. Gọi tên các hợp chất sau: CH3OH; CH3-CHO
b. Viết công thức cấu tạo thu gọn các hợp chất sau: axit fomic, butan-2-ol
Câu 2: (1 điểm) Bằng phương pháp hóa học hãy nhận biết các ống nghiệp đựng các dung dịch hóa chất sau: Axit axetic (CH3COOH), ancol etylic (C2H5OH), phenol (C6H5OH).
Câu 3: (0,5 điểm) Cho 9 gam một axit cacboxylic no, đơn chức, mạch hở tác dụng với natri dư thì thu được 1,68 lít khí H2 (đktc). Xác định công thức của axit cacboxylic?
Câu 4: (0,5 điểm) Cho sơ đồ phản ứng sau:
Metan X Y Z T
Xác định công thức các chất X, Y, Z, T và viết các phương trình (1), (2), (3), (4). Biết T là chất no đơn chức và có 4 nguyên tử cacbon trong phân tử
(Học sinh không được sử dụng tài liệu)
------ HẾT ------
ĐỀ SỐ 3
I. PHẦN TRẮC NGHIỆM (7 ĐIỂM)
Cho nguyên tử khối của các nguyên tố (đvC): H=1; He=4; C=12; N=14; O=16; Na=23; Mg=24; Al=27; P=31; S=32; Cl=35,5; K=39; Ca=40; Fe=56; Cu=64; Br=80; Ag=108; Ba=137;
Câu 1: Đun nóng butan-2-ol trong điều kiện H2SO4 đặc, 1700C tạo ra tối đa bao nhiêu anken là đồng phân của nhau (tính cả đồng phân hình học cis, trans)?
A. 3 B. 2 C. 1 D. 4
Câu 2: Metanol là một độc tố ngây chết người hàng đầu trong các vụ ngộ độc rượu. Công thức phân tử của metanol là
A. HCHO. B. C6H5OH. C. CH3OH. D. C6H5CH2OH.
Câu 3: Tên thay thế của ancol có công thức cấu tạo thu gọn CH3CH2CH2OH là
A. propan-2-ol. B. pentan-1-ol. C. pentan-2-ol. D. propan-1-ol.
Câu 4: Đun nóng một ancol đơn chức X thu được 14,8 gam ete và 3,6 gam H2O. Công thức ancol X là
A. C3H5OH. B. C3H7OH C. C4H7OH. D. C2H5OH.
Câu 5: Thủy phân chất X trong nước thu được khí metan. Vậy X là
A. Al4C3. B. CaO. C. Na. D. CaC2.
Câu 6: Cho 0,01 mol phenol (C6H5OH) tác dụng vừa đủ với dung dịch Br2 loãng thu được m gam kết tủa trắng là 2,4,6 -tribromphenol. Giá trị của m là
A. 3,31. B. 6,62 C. 9,93. D. 4,43.
Câu 7: Hỗn hợp E gồm ancol etylic và hai hiđrocacbon mạch hở thuộc cùng dãy đồng đẳng. Hóa hơi m gam E thu được thể tích bằng với thể tích của 0,96 gam khí O2 ở cùng điều kiện. Mặt khác đốt cháy m gam E cần vừa đủ 0,3 mol O2, sau phản ứng thu được 0,195 mol CO2. Khối lượng C2H5OH trong hỗn hợp hợp E là
A. 0,92 gam. B. 0,69 gam. C. 0,46 gam. D. 0,23 gam.
Câu 8: Chất nào mất màu dung dịch Br2 là
A. Benzen B. Hexan C. Etilen D. Metan
Câu 9: Công thức tổng quát của ancol no, đơn chức, mạch hở là
A. CnH2n-1OH. B. CnH2n+2-OH. C. CnH2n-2-OH. D. CnH2n+1-OH.
Câu 10: Cho 224 ml khí etilen ở đktc phản ứng vừa đủ với V ml dung dịch Br2 0,5M. Giá trị của V là
A. 10 B. 20. C. 40 D. 80
Câu 11: Cho 12 gam ancol X no, đơn chức, mạch hở phản ứng với Na (dư) thu được 2,24 lit khí H2 (đktc). Công thức phân tử của X là:
A. C3H7OH. B. C2H5OH. C. CH3OH. D. C4H9OH
Câu 12: Đun nóng 11,6 gam C4H10 một thời gian, thu được hỗn hợp X gồm chất: H2, CH4, C2H6, C4H8, C3H6, C2H4, C4H10. Đốt cháy hoàn toàn X rồi cho sảng phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư, thấy khối lượng bình tăng lên m gam. Giá trị của m là?
A. 80,0. B. 35,2. C. 18.0. D. 53,2.
Câu 13: Đốt cháy hoàn toàn một hiđrocacbon X thu được 6,72 lít CO2 (đktc) và 7,2 gam H2O. CTPT của X là:
A. C2H6 B. C3H8 C. C4H10 D. C3H6
Câu 14: Đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm các ankan thu được 0,35 mol CO2 và m gam H2O. Giá trị của m là
A. 8,1 B. 9,0 C. 4,5 D. 7,2
Câu 15: Dãy đồng đẳng của axetilen hay ankin có công thức chung là
A. CnH2n+2 (n ≥ 2) B. CnH2n (n ≥ 2)
C. CnH2n-2 (n ≥ 2) D. CnH2n-6 (n ≥ 6)
Câu 16: Số đồng phân cấu tạo ancol ứng với công thức phân tử C4H10O là
A. 5. B. 3. C. 4. D. 2.
Câu 17: Ancol X là một ancol khi đốt cháy m gam thu được a mol CO2, còn nếu cho 2 m gam X tác dụng với Na dư thấy cũng thu được a mol khí H2. Vậy X là
A. Ancol etylic. B. Glixerol.
C. Ancol benzylic. D. Propan – 1,2 – điol.
Câu 18: Chất không tham gia phản ứng cộng với H2( Ni, t0) là
A. CH CH B. CH3-CH3
C. CH2=CH2 D. CH2=CH-CH=CH2
Câu 19: Cho 1 mẩu Na nhỏ bằng hạt đậu vào ống nghiệm chứa 2 - 3 ml chất lỏng X, thấy giải phóng khí Y. Đốt cháy Y trong không khí, thấy Y cháy với ngọn lửa màu xanh nhạt. Chất X là
A. benzen. B. Đietyl ete. C. Hexan. D. Etanol.
Câu 20: Nhỏ dung dịch Br2 loãng vào dung dịch chứa chất X nhận thấy nước brom mất màu, đồng thời có kết tủa trắng xuất hiện. Vậy X là
A. C2H5OH B. C6H5OH
C. C6H5-CH=CH2 D. CH3COOH
Câu 21: Phenol (C6H5OH) không phản ứng với chất nào sau đây?
A. Na. B. NaOH.
C. Dung dịch HCl. D. Dung dịch Br2.
Câu 22: Xăng sinh học E5 đang được khuyến khích người tiêu dùng sử dụng, là loại xăng có chứa 5% về thể tích etanol. Etanol là tên gọi của chất nào?
A. CH3OH. B. CH3CHO. C. C3H8O3. D. C2H5OH.
Câu 23: Đun nóng ancol etylic với H2SO4 đặc ở 170°C, thu được một hiđrocacbon có công thức là
A. C2H2. B. C2H6. C. C2H4. D. CH4.
Câu 24: Chất có hai liên kết đôi trong phân tử là?
A. CH2=CH-CH=CH2 B. CH2=CH-C CH
C. CH2=CH2 D. CH3-CH2- C CH
Câu 25: Ankan X có tỷ khối hơi so với H2 là 29. Vậy công thức của X là
A. C4H10 B. C4H8 C. C2H6 D. C3H8
Câu 26: Công thức CH¬2=CH2 có tên gọi là
A. Propilen. B. Etilen. C. Etan. D. Axetilen.
Câu 27: Khi cho 4,6 gam ancol etylic tác dụng hết với Na dư, thu được V lít khí H2 (đktc). Giá trị của V là
A. 4,48 lít. B. 1,12 lít. C. 3,36 lít. D. 2,24 lít.
Câu 28: Dẫn khí X đi qua dung dịch AgNO3/NH3 nhận thấy có kết tủa vàng nhạt xuất hiện. Vậy X là
A. CH CH B. CH2=CH2 C. CH4 D. CH3-CH3
II. PHẦN TỤ LUẬN (3 ĐIỂM)
Câu 1: (1 điểm)
Hoàn thành các phương trình hóa học sau
a) C6H5OH + NaOH b) CH3COOH + Na2CO3
c) C2H5OH + O2(dư) d) CH2=CH2 + HCl
Câu 2: (1 điểm) Bằng phương pháp hóa học hãy nhận biết các ống nghiệp đựng các dung dịch hóa chất sau: Axit axetic (CH3COOH), ancol etylic (C2H5OH), phenol (C6H5OH).
Câu 3: (0,5 điểm) : Đốt cháy hoàn toàn hỗn hợp các anken bằng oxi thu được 7,84 lít CO2(đktc) và m gam H2O. Giá trị của m là bao nhiêu?
Câu 4: (0,5 điểm) Đun nóng 11,6 gam C4H10 một thời gian, thu được hỗn hợp X gồm chất: H2, CH4, C2H6, C4H8, C3H6, C2H4, C4H10. Đốt cháy hoàn toàn X rồi cho sảng phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư, thấy khối lượng bình tăng lên m gam. Giá trị của m là?
(Học sinh không được sử dụng tài liệu)
------ HẾT ------
ĐỀ THAM KHẢO HÓA 12
ĐỀ 1
PHẦN TRẮC NGHIỆM: 7,0 điểm
Câu 1: Để điều chế kim loại kiềm, người ta dùng phương pháp nào sau đây?
A. Điện phân nóng chảy. B. Điện phân dung dịch. C. Thủy luyện. D. Nhiệt luyện.
Câu 2: Trong các hợp chất, K có số oxi hóa là
A. 0 và +1. B. +1. C. +1 và +2. D. +1 và -1.
Câu 3: Dung dịch thu được khi hòa tan kim loại Na vào nước là
A. NaOH. B. Na(OH)2. C. Na(OH)3. D. Na2O .
Câu 4: Kim loại nào sau đây là kim loại kiềm thổ?
A. Na. B. Fe. C. Ca. D. Cu.
Câu 5: Kim loại nào sau đây không tan trong nước ở bất kì nhiệt độ nào?
A. Ba. B. Ca. C. Mg. D. Be.
Câu 6: Công thức hóa học của thạch cao sống là
A. CaSO4.2H2O. B. CaSO4. C. CaSO4.3H2O. D. CaSO4.5H2O.
Câu 7: Nước cứng là nước có chứa nhiều ion
A. Mg2+, Ca2+. B. Ba2+, Mg2+. C. Cu2+, Mg2+. D. Na+, Ca2+.
Câu 8: Phèn chua được dùng trong ngành thuộc da, công nghiệp giấy, chất cầm màu trong công nghiệp nhuộm, chất làm trong nước. Công thức hóa học của phèn chua là
A. KAl(SO4)2.12H2O. B. NaAl(SO4)2.12H2O. C. NH4Al(SO4)2.12H2O. D. LiAl(SO4)2.12H2O.
Câu 9: Quặng nào sau đây dùng để sản xuất nhôm?
A. Boxit. B. Đolomit. C. Apatit. D. Pirit.
Câu 10: Tính chất vật lý nào dưới đây không phải của Fe?
A. Kim loại nặng, khó nóng chảy. B. Dẫn điện và dẫn nhiệt tốt.
C. Màu vàng nâu, dẻo, dễ rèn. D. Có tính nhiễm từ.
Câu 11: Fe phản ứng với dung dịch nào sau đây tạo khí H2?
A. H2SO4 loãng. B. HNO3. C. CuSO4. D. AgNO3.
Câu 12: Trong các loại quặng sắt, quặng có hàm lượng sắt cao nhất là
A. hematit nâu. B. manhetit. C. xiđerit. D. hematit đỏ.
Câu 13: Gang là hợp kim của
A. sắt với cacbon. B. sắt với photpho. C. sắt với lưu huỳnh. D. sắt với nhôm.
Câu 14: Các số oxi hóa thường gặp của Cr trong hợp chất là:
A. +1, +2, +6. B. +3, +4, +6. C. +2, +3, +6. D. +2, +4, +6.
Câu 15: Chất nào sau đây là oxit axit?
A. CrO3. B. FeO. C. Cr2O3. D. Fe2O3.
Câu 16: Tác nhân nào sau đây là nguyên nhân chính gây ra mưa axit?
A. NO2, SO2. B. SO3, CO2. C. CO2, NO2. D. N2, H2.
Câu 17: Khối lượng quặng boxit chứa 75% Al2O3 cần để sản xuất 1,5 tấn nhôm nguyên chất là (biết hiệu suất phản ứng điện phân đạt 90%)
A. 7,6 tấn. B. 8,4 tấn. C. 4,2 tấn. D. 3,8 tấn.
Câu 18: Hiện tượng xảy ra khi cho kim loại Na vào dung dịch CuSO4 là
A. sủi bọt khí không màu và có kết tủa màu xanh.
B. bề mặt kim loại có màu đỏ, dung dịch nhạt màu.
C. sủi bọt khí không màu và có kết tủa màu đỏ.
D. bề mặt kim loại có màu đỏ và có kết tủa màu xanh.
Câu 19: Nung hỗn hợp gồm MgCO3 và BaCO3 có cùng số mol đến khối lượng không đổi thu được khí X và chất rắn Y. Hòa tan Y vào nước dư, lọc bỏ kết tủa thu được dung dịch Z. Hấp thụ hoàn toàn khí X vào dung dịch T, sản phẩm sau phản ứng là
A. Ba(HCO3)2. B. BaCO3 và Ba(HCO3)2.
C. BaCO3 và Ba(OH)2. D. BaCO3.
Câu 20: Cho mẫu kim loại Mg vào dung dịch HNO3 loãng, sau phản ứng chỉ thu được dung dịch X. Muối có trong dung dịch X là
A. Mg(NO3)2. B. NH4NO3. C. Mg(NO3)2, NH4NO3. D. Mg(NO3)2, NH4NO2.
Câu 21: Dung dịch chất nào sau đây không thể hòa tan Al2O3?
A. NaOH. B. H2SO4. C. NH3. D. Ba(OH)2.
Câu 22: Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là
A. có kết tủa keo trắng và có khí thoát ra. B. có kết tủa keo trắng, sau đó kết tủa tan.
C. không có kết tủa, có khí thoát ra. D. chỉ có kết tủa keo trắng.
Câu 23: Hoà tan hoàn toàn m gam Fe trong dung dịch HNO3 loãng dư, sau khi phản ứng kết thúc thu được 0,448 lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A.11,2. B. 0,56. C. 5,60. D. 1,12.
Câu 24 :Hợp chất FeO thể hiện tính khử trong phản ứng với chất nào sau đây?
A. Dung dịch HNO3. B. Dung dịch HCl.
C. CO. D. Dung dịch H2SO4 loãng.
Câu 25 : Phương trình hóa học nào sau đây không đúng?
A. 2Cr + 3H2SO4 (loãng) Cr2(SO4)3 + 3H2.
B. 2Cr + 3Cl2 2CrCl3.
C. Cr(OH)3 + 3HCl CrCl3 + 3H2O.
D. Cr2O3 + 2NaOH (đặc) 2NaCrO2 + H2O.
Câu 26 : Cho các phát biểu sau:
(a) Lưu huỳnh, photpho, cacbon đều phản ứng với CrO3.
(b) Bột nhôm dễ phản ứng với khí Cl2.
(c) Phèn chua có công thức là KAl(SO4)2.12H2O.
(d) Cr2O3 là oxit lưỡng tính.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
Câu 27 : Hòa tan hoàn toàn hỗn hợp X gồm 0,02 mol Cr và 0,03 mol Fe trong trong dung dịch H2SO4 loãng dư thu được V lít H2 (đktc). Giá trị của V là
A. 1,120. B. 2,240. C. 0,448. D. 0,672.
Câu 28 : Cho các phát biểu sau:
(a) Trong tự nhiên, kim loại kiềm chỉ tồn tại dạng hợp chất.
(b) Al tác dụng mạnh với dung dịch HNO3 đặc nóng và H2SO4 đặc nóng.
(c) Có thể dùng dung dịch Na2CO3 để làm mềm nước cứng tạm thời.
(d) Hỗn hợp Cu và Fe2O3 với tỷ lệ mol 1 : 1 có thể tan hết trong nước dư.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
PHẦN TỰ LUẬN: 3,0 điểm
Câu 29 (1 điểm): Viết phương trình hóa học điều chế kim loại Ca từ CaCO3.
Câu 30 (1 điểm): Hòa tan hết 7,3 gam hỗn hợp bột Na, Al vào nước thu được 5,6 lít H2 (đktc).
a. Viết phương trình hóa học của các phản ứng xảy ra.
b. Tính phần trăm khối lượng của mỗi kim loại trong hỗn hợp.
Câu 31 (0,5 điểm): Hòa tan hoàn toàn 5,584 gam hỗn hợp Fe và Fe3¬O4 vào dung dịch HNO3 loãng, dư. Sau khi phản ứng hoàn toàn thu được 0,3136 lít khí NO (đktc, sản phẩm khử duy nhất của N+5) và dung dịch X chứa m gam muối. Tính giá trị m.
Câu 32 (0,5 điểm): Xác định các chất X, Y và viết phương trình hóa học của các phản ứng trong sơ đồ chuyển hóa sau:
NaOH X Y NaOH
------------------ Hết -----------------
ĐỀ 2
PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1. Kim loại nào sau đây được điều chế bằng phương pháp điện phân dung dịch?
A. Ba. B. Ag. C. Na. D. Ca.
Câu 2: Trong các hợp chất, Na có số oxi hóa là
A. 0 và +1. B. +1. C. +1 và +2. D. +1 và -1.
Câu 3: Natrihidrocacbonat có công thức phân tử là
A. NaOH. B. NaHCO3. C. NaCl. D. Na2SO4.
Câu 4: Trong bảng tuần hoàn, các kim loại kiềm thuộc nhóm
A. IA. B. IIA. C. IIIA. D. VA.
Câu 5: Sản phẩm thu được khi đốt Mg trong bình đựng khí clo là
A. MgCl2. B. MgCl. C. MgCl3. D. MgO.
Câu 6: Công thức hóa học của thạch cao nung là
A. CaSO4.2H2O. B. 2CaSO4.H2O. C. CaSO4.3H2O. D. CaSO4.
Câu 7: Cách làm mềm nước cứng tạm thời nào sau đây là đơn giản nhất?
A. Đun sôi B. Dùng dung dịch HCl loãng. C. Dùng dung dịch Na2CO3. D. Dùng dung dịch nước vôi trong.
Câu 8: Kim loại Al không có tính chất vật lí nào sau đây?
A. Dễ dát mỏng. B. Khối lượng riêng lớn C. Màu trắng bạc. D. Khá mềm.
Câu 9: Ứng dụng nào sau đây không đúng với nhôm và hợp kim của nhôm?
A. Hàn đường ray. B. Dụng cụ nhà bếp C. Chế tạo máy bay, ô tô, tên lửa. D. Dụng cụ y tế
Câu 10: Cấu hình electron nào sau đây là của ion Fe3+?
A. [Ar]3d6. B. [Ar]3d5. C. [Ar]3d4. D. [Ar]3d3.
Câu 11: Phương trình hóa học nào sau đây đúng?
A. Fe + H2SO4 → FeSO4 + H2. B. 2Fe + 6HCl → 2FeCl3 + 3H2.
C. Fe + 3AgNO3 → Fe(NO3)3 + 3Ag. D. Fe + Cl2 → FeCl2.
Câu 12: Công thức hóa học của sắt(II) clorua là
A. FeCl2. B. Fe(OH)3. C. FeSO4. D. Fe2O3.
Câu 13: Phát biểu nào sau đây không đúng?
A. Nguyên liệu sản xuất gang gồm quặng sắt, than cốc và chất chảy.
B. Chất khử trong quá trình sản xuất gang là cacbon monooxit.
C. Thép là hợp kim của sắt, chứa từ 0,01-2% khối lượng cacbon, ngoài ra còn có một số nguyên tố khác.
D. Để chuyển hóa gang thành thép có thể dùng bột nhôm để khử oxit sắt.
Câu 14: Trong các kim loại: Fe, Al, Na, Cr, kim loại cứng nhất là
A. Fe. B. Au. C. W. D. Cr.
Câu 15: Hợp chất nào sau đây có tính lưỡng tính?
A. CrCl3. B. NaOH. C. KOH D. Cr(OH)3.
Câu 16: Chất bột được dùng để khử tính độc của thuỷ ngân là
A. vôi sống. B. cát. C. lưu huỳnh. D. muối ăn.
Câu 17: Nguyên tắc chung để điều chế kim loại là
A. khử ion kim loại thành kim loại. B. oxi hóa kim loại thành ion kim loại.
C. oxi hóa ion kim loại thành kim loại. D. khử ion kim loại thành nguyên tử.
Câu 18: Cho 2,34 gam kim loại M thuộc nhóm IA phản ứng với H2O thu được 0,672 lit khí H2 (đktc) . Kim loại M là
A. K. B. Na. C. Li. D. Ag.
Câu 19: Dãy chất nào sau đây đều tác dụng với dung dịch Ca(OH)2?
A. Ca(HCO3)2, Na2CO3. B. MgO, HCl. C. NaHCO3, NaCl. D. Mg(OH)2, HCl.
Câu 20: Ứng dụng nào sau đây không phải của CaCO3?
A. Làm vôi quét tường. B. Làm vật liệu xây dựng.C. Sản xuất ximăng D. Sản xuật bột nhẹ để pha sơn.
Câu 21: Nhóm gồm tất cả các chất vừa tác dụng với dung dịch NaOH, vừa tác dụng với dung dịch HCl là
A. AlCl3, Al(OH)3. B. NaAlO2, Al2O3. C. Al2O3, Al(OH)3. D. Al2(SO4)3, NaAlO2.
Câu 22: Cho m gam Al phản ứng vừa đủ với 0,039 mol Cl2. Giá trị của m là
A. 1,053. B. 0,702. C. 0,175. D. 0,351.
Câu 23: Hòa tan 5,6 gam Fe trong lượng dư dung dịch HNO3 đặc nóng thấy thoát ra V lít khí NO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
A. 2,240. B. 4,480. C. 6,720. D. 8,960.
Câu 24: Thí nghiệm nào sau đây thu được muối sắt (III)?
A. Cho Fe(OH)2 vào dung dịch H2SO4 loãng. B. Cho Fe dư vào dung dịch Fe(NO3)3.
C. Cho Fe vào dung dịch HNO3 loãng, dư. D. Cho FeO vào dung dịch HCl.
Câu 25: Dung dịch X có màu đỏ cam. Nếu cho thêm vào một lượng KOH, màu đỏ của dung dịch dần dần chuyển sang màu vàng tươi. Nếu thêm vào đó một lượng H2SO4, màu của dung dịch dần dần trở lại đỏ cam. Dung dịch X là
A. K2Cr2O7. B. K2Cr2O4. C. KCr2O4. D. KMnO4.
Câu 26: Cho các phát biểu sau:
(1) Dẫn CO2 dư vào dung dịch Ca(OH)2, kết thúc phản ứng thu được kết tủa.
(2) Crom là kim loại có tính khử mạnh hơn sắt.
(3) Nhỏ đến dư dung dịch NH3 vào dung dịch AlCl3 thấy xuất hiện kết tủa.
(4) CaSO4.H2O được dùng để bó bột, nặng tượng và đúc khuôn.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 27: Thí nghiệm nào sau đây không thu được kết tủa?
A. Cho dung dịch KOH vào dung dịch FeCl3.
B. Cho dung dịch AgNO3 vào dung dịch Na3PO4.
C. Cho dung dịch NaOH dư vào dung dịch Al(NO3)3.
D. Cho dung dịch BaCl2 vào dung dịch K2SO4.
Câu 28: Cho các thí nghiệm sau (các phản ứng xảy ra hoàn toàn):
(a) Cho hỗn hợp Na và Al (tỉ lệ mol 3:1) vào nước dư;
(b) Cho hỗn hợp BaO và NH4Cl (tỉ lệ mol 1:2) vào nước dư;
(c) Cho Mg vào dung dịch HNO3 loãng dư, không có khí thoát ra;
(d) Sục khí CO2 dư vào dung dịch Ba(OH)2;
(e) Cho 1,2x mol Fe vào dung dịch chứa 4x mol HNO3 đun nóng (NO là sản phẩm khử duy nhất).
Số thí nghiệm thu được dung dịch chứa hai chất tan là
A. 4. B. 2. C. 5. D. 3.
PHẦN TỰ LUẬN:
Câu 29 (1,0 điểm): Viết phương trình hóa học các phản ứng trong sơ đồ chuyển hóa sau:
Fe FeBr3 Fe(OH)3¬ Fe2O3 Fe3O4
Câu 20 (1,0 điểm): Cho m gam hỗn hợp X gồm Al và Cr tác dụng với dung dịch HCl loãng, nóng dư thu được 10,08 lít H2 (đktc). Cũng lượng hỗn hợp X trên tác dụng với lượng dư dung dịch NaOH thu được 6,72 lít H2 (đktc).
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính m.
Câu 31 (0,5 điểm): Có 4 mẫu bột kim loại: K, Al, Fe, Ca. Chỉ dùng nước làm thuốc thử, trình bày cách nhận biết 4 kim loại trên.
Câu 32 (0,5 điểm): Cho một luồng khí CO đi qua ống sứ đựng 0,04 mol hỗn hợp A gồm FeO và Fe2O3 đốt nóng. Sau khi kết thúc thí nghiệm thu được hỗn hợp B gồm bốn chất nặng 4,784 gam. Khí đi ra khỏi ống sứ cho hấp thụ vào dung dịch Ba(OH)2 dư tạo thành 9,062 gam kết tủa.Tính thành phần phần trăm của khối lượng của từng chất trong hỗn hợp A.
ĐỀ 3
PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1. Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
A. Ag. B. Na. C. Fe. D. Cu.
Câu 2. Ở nhiệt độ thường, kim loại Na phản ứng với H2O, thu được H2 và chất nào sau đây?
A. NaCl. B. Na2O. C. NaOH. D. Na2O2.
Câu 3. Kim loại nào sau đây là kim loại kiềm?
A. Ca. B. K. C. Cu. D. Al.
Câu 4. Khi so sánh với kim loại kiềm cùng chu kì, nhận xét nào dưới đây đúng về kim loại kiềm thổ?
A. Khối lượng riêng nhỏ hơn. B. Độ cứng lớn hơn.
C. Nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn. D. Thế điện cực chuẩn nhỏ hơn.
Câu 5. Để phân biệt dung dịch CaCl2 với dung dịch NaCl, người ta dùng dung dịch
A. HNO3. B. Na2CO3. C. NaNO3. D. KNO3.
Câu 6. Nước cứng là nước
A. chứa nhiều ion Ca2+ , Mg2+. B. chứa một lượng cho phép Ca2+ , Mg2+.
C. không chứa Ca2+ , Mg2+ D. chứa nhiều Ca2+ , Mg2+ , HCO3-.
Câu 7. Thạch cao nung có công thức hóa học là
A. CaCO3. B. CaSO4.2H2O. C. CaSO4. D. CaSO4.H2O.
Câu 8. Phát biểu nào sau đây không đúng với nhôm?
A. Ở ô thứ 12, chu kì 3, nhóm IIIA. B. Cấu hình electron nguyên tử: [Ne] 3s23p1.
C. Mức oxi hóa đặc trưng trong hợp chất là +3. D. Có 3 electron ở lớp ngoài cùng.
Câu 9. Sản phẩm của phản ứng nhiệt nhôm luôn có
A. Al. B. Al(OH)3. C. Al2O3. D. O2.
Câu 10. Cấu hình electron nào sau đây là của Fe?
A. [Ar] 4s23d6. B. [Ar]3d64s2. C. [Ar]3d8. D. [Ar]3d74s1.
Câu 11. Tính chất vật lý nào sau đây của sắt khác với các đơn chất kim loại khác?
A. Tính dẻo, dễ rèn. B. Có tính nhiễm từ. C. Dẫn điện và nhiệt tốt. D. Là kim loại nặng.
Câu 12. Phát biểu nào không đúng?
A. Gang là hợp chất Fe-C. B. Hàm lượng C trong gang nhiều hơn trong thép.
C. Gang là hợp kim Fe-C và 1 số nguyên tố khác. D. Gang trắng chứa ít C hơn gang xám.
Câu 13. Sắt(III) oxit có công thức hóa học là
A. Fe2O3. B. FeO. C. Fe3O4. D. Fe(OH)2.
Câu 14. Oxit lưỡng tính là
A. Cr2O3. B. MgO. C. CrO. D. CaO.
Câu 15. Các số oxi hoá đặc trưng của crom trong hợp chất là:
A. +2, +4, +6. B. +2, +3, +6. C. +1, +2, +4, +6. D. +3, +4, +6.
Câu 16. Chất khí nào sau đây là một trong các nguyên nhân gây ra hiệu ứng nhà kính?
A. SO2. B. CO2. C. NH3. D. N2.
Câu 17. Khi điều chế kim loại các ion kim loại đóng vai trò là chất
A. cho electron. B. bị khử. C. nhận proton. D. bị oxi hoá.
Câu 18. Kim loại kiềm có nhiệt độ nóng chảy thấp là do
A. khối lượng riêng nhỏ. B. tính khử của kim loại mạnh.
C. bán kính nguyên tử lớn. D. lực liên kết kim loại trong mạng tinh thể kém bền.
Câu 19. Trong các kim loại kiềm thổ: Mg, Ca, Sr, Ba. Kim loại có tính khử mạnh nhất là
A. Sr. B. Ca. C. Ba. D. Mg.
Câu 20. Sục 6,72 lít khí CO2 (đktc) vào dung dịch Ca(OH)2 dư. Kết thúc phản ứng khối lượng kết tủa thu được là
A. 15 gam. B. 25 gam. C. 20 gam. D. 30 gam.
Câu 21. Nhôm hiđroxit không phản ứng được với chất nào sau đây?
A. Dung dịch KOH. B. Dung dịch H2SO4. C. Dung dịch H2SO4 đặc nguội. D. Dung dịch NH3¬.
Câu 22. Cho các chất: Al, Al2O3, AlCl3, Al(OH)3. Số chất phản ứng được với dung dịch HCl là
A. 2. B. 3. C. 1. D. 4.
Câu 23. Cho Fe dư vào dung dịch H2SO4 loãng thu được 6,72 lít khí (ở điều kiện tiêu chuẩn). Khối lượng Fe tham gia phản ứng là
A. 16,8 gam. B. 5,6 gam. C. 25,2 gam. D. 11,2 gam.
Câu 24. Dãy gồm hai chất chỉ có tính oxi hoá là
A. Fe(NO3)2, FeCl3. B. Fe(OH)2, FeO. C. Fe2O3, Fe2(SO4)3. D. FeO, Fe2O3.
Câu 25. Chất rắn màu lục, tan trong dung dịch HCl được dung dịch A. Cho A tác dụng với NaOH và brom được dung dịch màu vàng, thêm tiếp H2SO4 vào thì thu được dung dịch có màu da cam. Chất rắn đó là
A. Cr2O3. B. CrO. C. CrO3. D. Cr.
Câu 26. Cho các phát biểu sau:
(1) Lưu huỳnh, photpho, cacbon đều phản ứng với CrO3;
(2) Bột nhôm dễ phản ứng với khí Cl2;
(3) Phèn chua có công thức là KAl(SO4)2.12H2O;
(4) Cr2O3 là oxit lưỡng tính.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
Câu 27. Ứng dụng nào sau đây không đúng?
A. Khi nghiền clanhke, trộn thêm thạch cao để điều chỉnh tốc độ đông cứng của xi măng.
B. Đá vôi được dùng làm vật liệu xây dựng, sản xuất vôi, xi măng, …
C. Khi nung nóng, thạch cao sống bị mất nước tạo thành thạch nhũ trong các hang động.
D. Vôi tôi được sử dụng rộng rãi trong công nghiệp và nông nghiệp.
Câu 28. Trường hợp nào sau đây thu được kết tủa sau khi phản ứng xảy ra hoàn toàn?
A. Sục khí CO2 dư vào dung dịch Ca(OH)2.
B. Cho dung dịch NaOH dư vào dung dịch HCl.
C. Cho dung dịch Na3PO4 vào dung dịch Ca(HCO3)2.
D. Cho CaCO3 vào dung dịch HCl loãng, dư.
PHẦN TỰ LUẬN.
Câu 29 (1 điểm): Cho m gam hỗn hợp X gồm Al, Cr tác dụng với lượng dư dung dịch HCl loãng nóng dư không có không khí, thu được 1,456 lít khí H2 (ở đktc). Cũng m gam hỗn hợp X tác dụng với lượng dư dung dịch NaOH đặc thu được 1,008 lít khí H2 (ở đktc).
a) Viết phương trình hóa học của các phản ứng xảy ra?
b) Tính m?
Câu 30 (1 điểm): Hoàn thành sơ đồ chuyển hóa sau:
Ca(OH)2 NaOH Fe(OH)3¬ Fe2O3 Al2O3
Câu 31 (0,5 điểm):Cho các dung dịch đựng riêng biệt trong các lọ mất nhãn sau: NH4Cl, NaCl, BaCl2, Na2CO3. Chỉ dùng thêm một thuốc thử, trình bày cách nhận biết 4 chất trên? Viết các phương trình hóa học của các phản ứng xảy ra(nếu có)?
Câu 32 (0,5 điểm): Hoà tan 5 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ thu được 0,56 lít khí H2 ở đktc và dung dịch A.
a) Tính % khối lượng mỗi chất trong hỗn hợp ban đầu?
b) Cho dung dich A tác dụng với dung dịch NaOH dư. Lấy kết tủa nung trong không khí đến khối lượng không đổi được m gam chất rắn X.(Biết hiệu suất các phản ứng là 100%). Tính m?
ĐỀ THAM KHẢO HÓA 11
ĐỀ THAM KHẢO KIỂM TRA HỌC KỲ 2
Môn: Hoá học - Lớp 11
Thời gian: 45 phút
ĐỀ THAM KHẢO SỐ 1
I–Trắc nghiệm
Câu 1. Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là:
A. ns2np3 B. ns2np4 C. ns2np5 D. ns2np6
Câu 2. Chất X là chất khí ở điều kiện thường, có màu vàng lục, dùng để khử trùng nước sinh hoạt… Chất X là: A. O2 B. Cl2 C. SO2 D. O3
Câu 3. Cho 15,8 gam KMnO4 tác dụng hoàn toàn với HCl đặc, dư. Thể tích khí thu được ở (đktc) là:
A. 5,6 lít B.3,36 lít C. 2,24 lít D. 1,12 lít
Câu 4. Cho lần lượt các chất sau: Cu, C, MgO, KBr, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3 tác dụng với dung dịch H2SO4 đặc, nóng. Số phản ứng oxi hoá - khử là:
A. 9 B. 8 C. 7 D. 6
Câu 5. Thuốc thử có thể dùng để phân biệt được cả 4 lọ KF, KCl, KBr, KI là
A. AgNO3 B. NaOH C. quỳ tím D. Cu
Câu 6. Có 3 bình đựng 3 chất khí riêng biệt: O2, O3, H2S lần lượt cho từng khí này qua dung dịch KI có pha thêm hồ tinh bột, chất khí làm dung dịch chuyển màu xanh là :
A. O2 B. H2S C. O3 D. O3 và O2
Câu 7. Có 4 dd sau đây: HCl , Na2SO4 , NaCl , Ba(OH)2 . Chỉ dùng thêm 1 hóa chất nào sau đây để phân biệt được 4 chất trên?
A. Na2SO4. B. Phenolphtalein. C. dd AgNO3 . D. Quỳ tím
Câu 8. Cu kim loại có thể tác dụng với chất nào trong các chất sau?
A. Khí Cl2. B. Dung dịch HCl. C. Dung dịch KOH đặc D. Dung dịch H2SO4 loãng.
Câu 9. Dẫn khí clo qua dung dịch NaOH ở nhiệt độ phòng, muối thu được là:
A. NaCl, NaClO3 B. NaCl, NaClO C. NaCl, NaClO4 D. NaClO, NaClO3
Câu 10. Dãy chất nào sau đây vừa có tính oxi hoá, vừa có tính khử?
A. O2 , Cl2 , H2S. B. S, SO2 , Cl2 C. F2, S , SO3 D. Cl2 , SO2¬, H2SO4
Câu 11. Dãy chất tác dụng được với dung dịch H2SO4 đặc nguội là:
A. CaCO3, Al, CuO B. Cu, MgO, Fe(OH)3 C. S, Fe, KOH D. CaCO3, Au, NaOH
Câu 12. Dung dịch axit HCl tác dụng được với dãy chất nào sau đây:
A. Zn, CuO, S. B. Fe, Au, MgO C. CuO, Mg, CaCO3 D. CaO, Ag, Fe(OH)2
Câu 13. Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng:
A. Xuất hiện chất rắn màu đen B. Chuyển sang màu nâu đỏ
C. Vẫn trong suốt, không màu D. Bị vẩn đục, màu vàng.
Câu 14. Hấp thụ 6,72 lít khí SO2 (đktc) vào 250 ml dung dịch NaOH 2M. Dung dịch sau phản ứng chứa:
A. NaHSO3 1,2M. B. Na2SO3 1M .
C. NaHSO3 0,4M và Na2SO3, 0,8M. D. NaHSO3 0,5M và Na2SO3, 1M.
Câu 15. Hòa tan 10,8 gam một kim loại R có hóa trị không đổi vào dung dịch HCl loãng dư thu được 10,08 lít H2 (ở đktc). Kim loại R là:
A. Mg B. Fe C. Zn D. Al
Câu 16. Hòa tan hết m gam hỗn hợp CuO, MgO, Fe2O3 vào 400 ml dung dịch axit HCl 3M vừa đủ. Cô cạn dung dịch sau phản ứng thu được 65 gam muối khan. Tính m?
A. 22,4 g B. 32,0 g C. 21,2 g D. 30,2 g
Câu 17. Oxi hóa 16,8 gam sắt bằng V lít không khí (ở đktc) thu được m gam chất rắn A gồm (Fe, FeO, Fe2O3, Fe3O4). Hòa tan hết A bằng dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 sản phẩm khử duy nhất. Tính V (Biết các khí đo ở đktc và O2 chiếm 1/5 thể tích không khí).
A. 33,6 lit B. 11,2 lít C. 2,24 lít D. 44,8 lít
Câu 18. Phương pháp để điều chế khí O2 trong phòng thí nghiệm là:
A. Điện phân H2O B. Chưng cất phân đoạn không khí lỏng
C. Nhiệt phân KMnO4 D. Điện phân dung dịch NaCl
Câu 19. Thuốc thử để phân biệt 2 bình đựng khí H2S, O2 là:
A. Dd HCl B. Dd KOH C. Dd NaCl D. Dd Pb(NO3)2
Câu 20. Trộn 100 ml dung dịch H2SO4 2M và 208g dung dịch BaCl2 15% thì khối lượng kết tủa thu được là:
A. 58,25g B. 23,30g C. 46,60g D. 34,95g.
ĐỀ THAM KHẢO SỐ 2
Câu 1: Muốn pha loãng dung dịch axit H2SO4 đặc cần phải:
A. Rót từ từ nước vào dung dịch axit đặc. B. Rót từ từ dung dịch axit đặc vào nước
C. Rót nhanh dung dịch axit vào nước D. Rót nước thật nhanh vào dung dịch axit đặc
Câu 2: Cho các yếu tố sau:
a. áp suất b. xúc tác c. nồng độ chất. d. nhiệt độ e. diện tích tiếp xúc.
Những yếu tố ảnh hưởng đến tốc độ phản ứng nói chung là:
A.a, b, c, d. B. b, c, d, e. C. a, c, e. D. a, b, c, d, e.
Câu 3: Trong phòng thí nghiệm, người ta thường điều chế khí Clo bằng cách:
A. Điện phân dung dịch NaCl có màng ngăn B. Điện phân nóng chảy NaCl
C. Cho F2 đẩy Cl2 khỏi dung dịch NaCl D. Cho dung dịch HCl đặc tác dụng với MnO2
Câu 4: Lưu huỳnh có các mức oxi hóa là
A. -2, 0, +4, +6 B. -1; 0; +1; +3; +5; +7 C. +1; +3; +5; +7 D. -2; 0; +6; +7
Câu 5: Cho phản ứng hóa học SO2 + Br2 + H2O → HBr + H2SO4. Hệ số cân bằng của phản ứng trên lần lượt là?A. 2,1,2,1,2 B. 2,2,1,1,2 C. 1,1,2,2,1 D. 1,2,1,2,1
Câu 6: Thuốc thử có thể dùng để phân biệt được cả 4 lọ KF, KCl, KBr, KI là
A. AgNO3 B. NaOH C. quỳ tím D. Cu
Câu 7: Nước Gia-ven được điều chế bằng cách
A. Cho clo tác dụng với nước B. Cho clo sục vào dung dịch NaOH
C. Cho clo sục vào dung dịch KOH đặc nóng D. Cho clo tác dụng với Ca(OH)2
Câu 8: Nước clo hoặc khí clo ẩm có tính tẩy màu (tẩy trắng) vì nguyên nhân là :
A. Clo hấp thụ màu B. Nước clo chứa HClO có tính oxi hóa mạnh, tẩy màu
C. Clo tác dụng với nước tạo ra HCl có tính tẩy màu D. Tất cả đều đúng
Câu 9: Để phân biệt được 3 chất khí : CO2, SO2 và O2 đựng trong 3 bình mất nhãn riêng biệt , người ta dùng thuốc thử là:
A. Dung dịch Br2 B. Nước vôi trong (dd Ca(OH)2) và dung dịch Br2
C. Nước vôi trong (dd Ca(OH)2) D. Dung dịch KMnO4
Câu 10: Cho 16,25 gam một kim loại M hoá trị II tác dụng vừa đủ với 250ml dung dịch HCl 2M. Kim loại M là:A. Al B. Cu C. Zn D. Mg
Câu 11: Kim loại nào dưới đây có phản ứng với axit H2SO4 đặc, nguội?
A. Fe B. Al C. Zn D. Cr
Câu 12: Cho các chất: O2, S, SO2, H2S, H2SO4. Có bao nhiêu chất vừa có tính oxi hóa, vừa có tính khử?
A. 4. B. 2. C. 1. D. 3.
Câu 13: Đổ dung dịch chứa 1 gam HCl vào dung dịch chứa 1 gam NaOH. Nhúng quỳ tím vào dung dịch thu được thì quỳ tím chuyển sang màu nào?
A. Màu xanh B. Màu đỏ C. Màu tím D. Màu vàng
Câu 14: Cấu hình electron lớp ngoài cùng của lưu huỳnh là :
A. 3s23p4 B. 3s23p6 C. 3s23p3 D. 2s22p4
Câu 15: Tầng ozon có khả năng ngăn tia cực tím từ vũ trụ thâm nhập vào trái đất vì
A. Tầng ozon có khả năng phản xạ ánh sáng tím.
B. Tầng ozon đã hấp thụ tia cực tím cho cân bằng chuyển hóa ozon và oxi.
C. Tầng ozon rất dày, ngăn không cho tia cực tím đi qua.
D. Tầng ozon chứa khí CFC có tác dụng hấp thụ tia cực tím.
Câu 16: Cho hệ cân bằng sau được thực hiện trong bình kín : 2SO2(k) + O2(k) 2SO3 (k), H < 0
Yếu tố nào sau đây giúp làm tăng hiệu suất tổng hợp SO3?
A. Giảm nhiệt độ, tăng áp suất B. Tăng nhiệt độ, giảm áp suất
C. Tăng nhiệt độ, tăng áp suất D. Giảm nhiệt độ, giảm áp suất
Câu 17: Cho các phương trình hóa học sau:
(1) F2 + H2O → HF + HFO (2) 2KBr + I2 → 2KI + Br2
(3) NaF + AgNO3 → AgF + NaNO3 (4) Cl2+ 2FeCl2→ 2FeCl3
Số phương trình hóa học không đúng là: A. 4 B. 3 C. 2 D. 1
Câu 18: Cho 2,8 g 1 kim loại R bằng H2SO4 đặc nóng thu được 1,68 lít khí SO2 (đktc) sản phẩm khử duy nhất. R là:A. Cu B. Al C. Fe D. Ag
Câu 19: Kim loại Cu không phản ứng được với chất nào sau đây:
A. H2SO4 loãng B. H2SO4 đặc C. O2 D. Cl2
Câu 20: Trong các chất sau, chất nào chỉ có tính khử?
A. S. B. SO2. C. H2S. D. H2SO4.
ĐỀ THAM KHẢO SỐ 3
Câu 1: Dẫn khí X đến dư qua dung dịch brom, thấy dung dịch brom bị mất màu. Khí X có thể là
A. SO3. B. CO2. C. SO2. D. Cl2.
Câu 2: Hấp thụ hoàn toàn 2,24 lit khí SO2 (đktc) vào dung dịch chứa 0,2 mol NaOH. Sau phản ứng thu được dung dịch chứa muối
A. NaHSO3. B. Na2S. C. Na2SO3. D. Na2SO4.
Câu 3: Nhiệt phân hoàn toàn 30,02 gam KMnO4 với hiệu suất là 75%, thể tích O2 (đktc) thu được là
A. 2,128 lít. B. 2,837 lít. C. 1,596 lít. D. 2,576 lít.
Câu 4: Cho m gam Cu tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng (dư) thu được 6,72 lít khí SO2 (ở đktc, sản phẩm khử duy nhất). Giá trị của m là
A. 9,6. B. 4,8. C. 1,92. D. 19,2.
Câu 5: Một mẫu khí thải công nghiệp có nhiễm các khí H2S, CO, CO2. Để nhận biết sự có mặt của H2S trong mẫu khí thải đó, ta dùng dung dịch
A. NaOH. B. Pb(NO3)2. C. Ca(OH)2. D. NaNO3.
Câu 6: Cho 20 gam hỗn hợp KHCO3 và CaCO3 vào dung dịch HCl dư, sau khi phản ứng hoàn toàn thu được V lit khí (đktc). Giá trị của V là
A. 4,48. B. 1,12. C. 2,24. D. 3,36.
Câu 7: Hòa tan hoàn toàn 14,40 gam kim loại M (hóa trị II) trong dung dịch HCl loãng (dư) thu được 13,44 lít khí H2 (đktc). Kim loại M làA. Mg. B. Ca. C. Ba. D. F.
Câu 8: Hòa tan hoàn toàn 6,1 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 2,24 lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 31,80. B. 31,40. C. 15,7. D. 8,98.
Câu 9: Dùng bông tẩm dung dịch axit sunfuric rồi viết lên tờ giấy trắng, sau đó hơ nóng trên ngọn lửa đèn cồn thì thấy nét chữ xuất hiện màu đen do dung dịch axit sunfuric đặc có tính háo nước. Axit sunfuric có công thức phân tử làA. HCl. B. H2S. C. Na2SO4. D. H2SO4.
Câu 10: Kim loại nào sau đây phản ứng được với dung dịch H2SO4 đặc nguội?
A. Au. B. Cu. C. Fe. D. Al.
Câu 11: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là:
A. Ag,Mg,Pb,Fe. B. Cu,Zn,Au,Pt C. Cu,Zn,Ca,Al D. Mg,Na,Fe,Al
Câu 12: Phản ứng nào không xảy ra được giữa các cặp chất sau?
A. Ba(NO3)2 và Na2SO4B. AgNO3 và NaCl C. Cu(NO3)2 và NaOH D. KNO3 và NaCl
Câu 13: Phản ứng tổng hợp NH3 theo phương trình hóa học N2 + 3 H2 2NH3 ; .
Để cân bằng chuyển dời theo chiều thuận cần:
A. giảm nhiệt độ B. A và C C. tăng nhiệt độ D. tăng áp suất
Câu 14: Cho 14.7g axit sunfuric loãng tác dụng với Fe dư. Tính thể tích khí bay ra vào cho biết tên chất khí.
A. 1,68 lít H¬2 B. 3,36 lít H2 C. 3,36 lít SO2 D. 1,68 lít SO2
Câu 15: Cho 15,8 gam KMnO4 tác dụng hoàn toàn với HCl đặc, dư. Thể tích khí thu được ở (đktc) là:
A. 3,36 lít B. 1,12 lít C. 5,6 lít D. 2,24 lít
Câu 16: Tính oxi hoá của các halogen được sắp xếp như sau:
A. Cl2 > F2 > Br2 > I2 B. I2> Br2 >Cl2 > F2 C. F2 >Cl2 > Br2 > I2 D. Br2 > F2> I2 >Cl2
Câu 17: Đặc điểm chung của các nguyên tố halogen là:
A. vừa có tính oxi hóa, vừa có tính khử B. có tính oxi hóa mạnh
C. Ở điều kiện thường là chất khí D. tác dụng mạnh với nước
Câu 18: Hơi thủy ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là:A. Cát B. Muối ăn C. Lưu huỳnh D. Vôi sống
Câu 19: Cho 16 gam hỗn hợp bột Fe và Mg tác dụng với dung dịch HCl dư thấy có 1 gam khí H2 bay ra. Khối luợng muối tạo ra trong dung dịch là:
A. 51,5 gam. B. 33,75 gam. C. 87 gam. D. 52,5 gam.
Câu 20: Cho 18,2 gam hỗn hợp 2 kim loại Cu và Al vào dung dịch HCl thu được 6,72 lít khí H2 (đktc), dung dịch X và chất rắn không tan B. Cho B phản ứng với H2SO4 đặc thu 4,48 lít khí SO2 (đktc). Khối lượng mỗi kim loại trong hỗn hợp ban đầu lần lượt là:
A. 12,8 gam Cu và 11,8 gam Al B. 6,4 gam Cu và 5,4 gam Al
C. 6,4 gam Cu và 11,8 gam Al D. 12,8 gam Cu và 5,4 gam Al
B. BÀI TẬP TỰ LUẬN
Câu 1: Thực hiện các dãy chuyển hóa sau, ghi rõ điều kiện phản ứng (nếu có):
a) NaCl → Cl2 → HCl → NaCl → HCl → Cl2 → Br2 → I2 → AlI3
b)FeS2 SO2 S SO2 SO3 H2SO4 FeSO4 FeCl3 Fe(NO3¬)3
c) KClO3 O2 SO2 H2SO4 CuSO4 Fe2(SO4)3 BaSO4
Câu 2: Nêu hiện tượng và viết ptpư khi:
a) Cho dd Na2¬S vào dd Pb(NO3)2. b) Để lâu lọ chứa dd H2S mở nắp lâu ngày.
c) Sục khí SO2¬ vào dd nước Br2. d) Cho H2SO4 đặc vào cốc chứa đường saccarozơ.
Câu 3: Viết phương trình hóa học chứng minh
a) Cl2 vừa có tính khử vừa có tính oxi hóa.
c) Tính oxi hóa của Br2 > I2.
d) Tính oxi hóa của O3 mạnh hơn O2.
Khí SO2¬ làm mất màu dd nước Br2.
Câu 4: Hòa tan 8,3 gam hỗn hợp gồm Al và Fe trong dung dịch HCl dư thu được 5,6 lít khí H¬2 (đkc) và dung dịch A.
a)Tính % khối lượng mỗi kim loại có trong hỗn hợp ban đầu ?
b)Tính thể tích dd HCl 2M ban đầu, biết người ta dùng dư 10% so với lí thuyết.
c)Tính nồng độ mol/lit của các chất có trong dung dịch A?
Câu 5: Hỗn hợp X gồm 11,2 gam Fe và 7,2 gam FeO. Cho toàn bộ hỗn hợp X tác dụng dung dịch H2SO4 loãng dư thu được dung dịch Y và V1 lít khí (đktc). Cô cạn dung dịch Y thu được m gam muối khan.
a) Tính m và V1.
b) Nếu cho toàn bộ hỗn hợp X ở trên tác dụng với dung dịch H2SO4 đặc, nóng dư thu được V2 lít khí SO2 (đktc, sản phẩm khử duy nhất). Tính V2.
Câu 6: Đun nóng hỗn hợp gồm 6,72 gam Fe và 3,2 gam S trong điều kiện không có không khí đến khi phản ứng hoàn toàn thu được chất X. Cho X tác dụng với dung dịch H2SO4 đặc nóng dư thu được V lít khí SO2 (đktc, sản phẩm khử duy nhất).
a) X chứa chất gì? Khối lượng bằng bao nhiều?
b) Tính V?
Câu 7: Cho m gam hỗn hợp X gồm Fe và Cu. Chia hỗn hợp X thành 2 phần bằng nhau.
Phần 1: cho tác dụng với dung dịch H2SO4 loãng, dư thu được 1,12 lít khí (đktc)
Phần 2: cho tác dụng vừa đủ với V lít dung dịch H2SO4 đặc, nguội (98% ,D= 1,84g/ml) thu được 4,1216 lít khí (đktc)
a, Tính m và phần trăm theo khối lượng mỗi kim loại trong X
b, Tính V
Câu 8: Cho cân bằng hoá học: N2(k) + 3H2(k) 2NH3(k) ∆H <0.
Cân bằng trên chuyển dịch theo chiều nào khi:
a) Thêm vào một lượng H2.
b) Tăng áp suất của hệ.
c) Tăng nhiệt độ của hệ.
Câu 9: Cân bằng hóa học sau được thiết lập trong bình kín:
2SO2(k) + O2(k) 2SO3(k) ∆H <0
Cân bằng phản ứng sẽ chuyển dịch về phía nào khi:
a. Thêm một lượng oxi vào hệ b. Giảm nhiệt độ của hệ c. Tăng áp suất của hệ.
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
II–Tự luận (5,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
a. Fe + Cl2 ……………………………………………………………………………………………
b. Ba(NO3)2 + MgSO4 …………………………………………………………………………………….
c. HCl + Mg(OH)2 ……………………………………………………………………………………….
d. P + H2SO4 đặc, nóng …………………………………………………………………………………
e. Al + H2SO4 đặc, nóng SO2 + H2S + ..... ……………………………………………………
(biết tỉ lệ mol SO2 và H2S là 1 : 3)
Bài 2. (2,5 điểm)
Hòa tan 22,8 gam hỗn hợp X gồm Mg và Fe vào dung dịch H2SO4 98% (đặc, nóng, dư). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và thu được dung dịch Y.
a. Tính thành phần % khối lượng mỗi kim loại trong X. (1,5 điểm)
b. Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 400 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO4 98% ban đầu. (0,5 điểm)
c. Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 2:1) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng. (0,5 điểm)
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
ĐỀ THAM KHẢO HÓA 11
A. PHẦN TRẮC NGHIỆM KHÁCH QUAN (7 điểm)
Câu 1: Etan có công thức phân tử là
A. C3H6. B. C3H8. C. C2H4. D. C2H6.
Câu 2: Chất nào sau đây là đồng phân của but – 2 – en?
A. But – 1 – en. B. But – 2 – in. C. But – 1 – in. D. Buta – 1,3 – đien.
Câu 3: Số liên kết đôi C=C trong phân tử isopren là
A. 2. B. 3. C. 4. D. 1.
Câu 4: Dãy đồng đẳng của benzen có công thức phân tử chung là
A. CnH2n + 2 với (n 1). B. CnH2n với (n 2). C. CnH2n – 2 với (n 3). D. CnH2n – 6 với (n 6).
Câu 5: Chất nào sau đây không làm mất màu dung dịch thuốc tím (KMnO4) ngay cả khi đun nóng?
A. Toluen B. Stiren C. Benzen D. Hexen
Câu 6: Ở điều kiện thường chất nào sau đây là chất lỏng?
A. Metan. B. Bezen. C. Etilen. D. Axetilen.
Câu 7: Tên thay thế của CH3OH là
A. etanol. B. metanol. C. propanol. D. ancol etylic.
Câu 8: Ancol etylic không tác dụng với chất nào sau đây?
A.Na. B. CuO (đun nóng). C. axit HBr (đun nóng). D. NaOH.
Câu 9: Glixerol có số nhóm hiđroxyl (-OH) trong phân tử là
A. 1. B. 2. C. 3 . D. 4.
Câu 10: Phenol không phản ứng với chất nào sau đây ?
A. Na. B. NaOH. C. NaHCO3. D. Br2.
Câu 11: Phenol rất độc, do đó khi sử dụng phenol phải hết sức cẩn thận. Công thức cấu tạo của phenol là
A. C6H5OH. B. C6H5CH2OH. C. C6H5CH3. D. C2H5OH.
Câu 12: Dung dịch nước của fomanđehit (fomon) được dùng làm chất tẩy uế, ngâm mẫu động vật làm tiêu bản, …. Công thức cấu tạo của fomanđehit là
A. HCHO. B. CH3CHO. C. C2H5CHO. D. (CH3)2CHCHO.
Câu 13:Chất nào sau đây tham gia phản ứng tráng bạc?
A. CH3OH. B. CH3CHO. C. C6H5OH. D. CH3COOH.
Câu 14: Anđehit axetic được điều chế trực tiếp từ chất nào sau đây?
A. metanol. B. propanol. C. etanol. D. phenol .
Câu 15: Công thức cấu tạo thu gọn của axit axetic là
A. CH3OH. B. CH3CHO. C. C6H5OH. D. CH3COOH.
Câu 16: Chất nào sau đây có nhiệt độ sôi cao nhất?
A. Axit fomic. B.Axit axetic . C. Etanal. D. Etan.
Câu 17: Đốt cháy hoàn toàn 0,015 mol C3H8, thu được H2O và m gam CO2. Giá trị của m là
A. 1,98. B. 0,54. C. 0,66. D.0,18 .
Câu 18: Chất nào sau đây là sản phẩm chính khi hiđrat hóa but – 1 – en?
A.CH3CH2CH(OH)CH3. B. CH3CH2CH2CH2OH. C. CH3CH2CH2CH3. D. CH3CH2CH2CH2Cl.
Câu 19: Phát biểu nào sau đây đúng?
A. Các hiđrocacbon thơm có nhiệt độ sôi tăng theo chiều tăng của phân tử khối.
B. Công thức phân tử của benzen là C8H8.
C. Toluen không làm mất màu dung dịch KMnO4 khi đun nóng.
D. Công thức phân tử chung dãy đồng đẳng của benzen là CnH2n-2 (n ).
Câu 20: Toluen tác dụng với Br2 ( t0) theo tỉ lệ mol 1:1, thu được chất hữu cơ X. Công thức cấu tạo thu gọn của X là
A.C6H5CH2Br . B. C6H5Br. C. CH3C6H4Br. D.C6H5CHBrCH2Br .
Câu 21: Cho a mol ancol CH3OH tác dụng hoàn toàn với kim loại Na dư, thu được 4,48 lít khí H2 (ở đktc). Giá trị của a là
A. 0,2. B. 0,6 . C. 0,4. D. 0,1.
Câu 22: Đun etanol với H2SO4 đặc ở 1800C, thu được chất nào sau đây?
A. Propen. B. Eten. C. Propan. D. Etan.
Câu 23: Chọn phát biểu sai:
A. Phenol có tính axit nhưng yếu hơn axit cacbonic.
B. Giữa nhóm -OH và vòng benzen trong phân tử phenol không có ảnh hưởng qua lại với nhau.
C. Phenol tác dụng được với natrihidroxit tạo thành muối và nước.
D. Dung dịch phenol không làm đổi màu quỳ tím vì tính axit của phenol rất yếu.
Câu 24: Cả phenol và ancol etylic đều phản ứng được với
A. Na B. NaOH C. Br2 D. NaHCO3.
Câu 25: Cho m gam CH3CHO tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 3,24 gam Ag. Giá trị của m là
A. 0,88. B. 0,44. C.1,32 . D. 0,66.
Câu 26: Hiđro hóa hoàn toàn metanal (xúc tác Ni,to), thu được sản phẩm là
A. axit axetic. B. ancol etylic. C. metanol. D. etilen.
Câu 27: Nhỏ dung dịch chất nào sau đây vào đá vôi, thấy có khí CO2 thoát ra?
A. Phenol. B. Axit axetic. C. Metanol. D. Propanal.
Câu 28: Để phân biệt ba dung dịch: dung dịch etanol, dung dịch glixerol và dung dịch phenol, ta lần lượt dùng các hóa chất nào sau đây ?
A. Na, nước Br2. B. NaOH, Na C. nước Br2, Cu(OH)2 D. nước Br2, Na.
B.PHẦN TỰ LUẬN (3 điểm)
Câu 29 (1 điểm). Hoàn thành các phương trình hóa học sau
a) C6H5OH + NaOH b) CH3COOH + Na2CO3
c) C2H5OH + O2(dư) d) CH2=CH2 + HCl
Câu 30 (1 điểm). X là ancol no, đơn chức mạch hở. Cho 3,6 gam X tác dụng với Na dư thu được 0,672 lít H2 (ở đktc). Viết công thức cấu tạo và gọi tên của X.
Câu 31 (0,5 điểm). Chia m gam hỗn hợp A gồm axit axetic và ancol etylic thành 2 phần bằng nhau.
Phần 1: tác dụng hết với Na dư thu được 2,24 lit khí H2 (đktc).
Phần 2: trung hòa vừa đủ với 150 ml dd NaOH 1M.
Tính m?
Câu 32 (0,5 điểm). Hợp chất hữu cơ X (phân tử có vòng benzen) có CTPT là C7H8O2 , tác dụng được với Na và với NaOH. Biết:
- Khi cho a mol X tác dụng với Na dư thì thu được a mol khí H2.
- a mol X tác dụng vừa đủ với a mol dung dịch NaOH.
Xác định công thức cấu tạo thu gọn của X?
(Cho Ag= 108, C=12, H=1,O=16)
................HẾT.................
ĐỀ SỐ 2
(Biết C = 12; H = 1; O = 16; N = 14; Ag = 108; Na = 23; K = 39; Br = 80)
I. PHẦN TRÁC NGHIỆM (7 điểm)
Câu 1. Trong số các chất sau chất nào tác dụng được với dung dịch AgNO3 trong NH3 tạo kết tủa vàng?
A. B. CH3-CH=CH2 C. CH3-CH2-CH3 D. CH3-CH3
Câu 2. Dãy đồng đẳng anken có công thức phân tử chung là
A. CnH2n-2(n 2) B. CnH2n+2(n 1) C. CnH2n+1 (n 1) D. CnH2n(n 2)
Câu 3. Hiện nay nhiều nơi ở nông thôn đang sử dụng hầm biogas để xử lí chất thải trong chăn nuôi gia súc, cung cấp nhiên liệu cho việc đun nấu. Thành phần chính trong khí biogas là khí metan. Khí metan có công thức phân tử là
A. C3H6 B. C2H4 C. CH4 D. C2H2
Câu 4. Theo danh pháp IUPAC, hợp chất CH3-CH2-COOH có tên gọi là
A. Axit pentannoic B. Axit butanoic C. Axit propanoic D. Axit metanoic
Câu 5. Dẫn V lít (ở đktc) hỗn hợp X gồm axetilen và hiđro đi qua ống sứ đựng bột niken nung nóng, thu được khí Y. Dẫn Y vào lượng dư AgNO3 trong dung dịch NH3thu được 12 gam kết tủA. Khí đi ra khỏi dung dịch phản ứng vừa đủ với 16 gam brom và còn lại khí Z. Đốt cháy hoàn toàn khí Z thu được 2,24 lít khí CO2(ở đktc) và 4,5 gam nước. Giá trị của V bằng?
A. 11,2 lít B. 5,60 lít C. 8,96 lít D. 13,44 lít
Câu 6. Ancol là những hợp chất hữu cơ trong phân tử có nhóm…(1)….liên kết trực tiếp với….(2)…….. Điền cụm từ thích hợp vào (1) và (2).
A. , nguyên tử cacbon hoặc nguyên tử hiđro
B. –COOH (cacboxyl), nguyên tử cacbon hoặc nguyên tử hiđro
C. –OH (hiđroxyl), nguyên tử cacbon no
D. –CH=O, nguyên tử cacbon hoặc nguyên tử hiđro
Câu 7. Hóa hơi 8,64 gam hỗn hợp gồm một axit no, đơn chức, mạch hở X và một axit no, đa chức Y (có mạch cacbon hở, không phân nhánh) thu được một thể tích hơi bằng thể tích của 2,8 gam N2 (đo trong cùng điều kiện nhiệt độ, áp suất). Đốt cháy hoàn toàn 8,64 gam hỗn hợp hai axit trên thu được 11,44 gam CO2. Tính phần trăm khối lượng của X trong hỗn hợp ban đầu.
A. 72,22 % B. 35,25 % C. 65,15 % D. 27,78 %
Câu 8. Khi cho CH3-CH2-CH3 tác dụng với Cl2 (ánh sáng, tỉ lệ mol 1:1). Số sản phẩm monoclo tối đa thu được là
A. 1 B. 2 C. 4 D. 3
Câu 9. Nhóm chức của anđehit là
A. -NH2 B. -COOH C. -CHO D. -OH
Câu 10. Cho 4,6 gam glixerol tác dụng hết với V ml dung dịch HCl 1M. Giá trị của V bằng?
A. 250ml B. 300 ml C. 150ml D. 200ml
Câu 11. Giấm là một chất lỏng có vị chua, được hình thành nhờ sợ lên men của ancol etylic. Thành phần chính của giấm là axit axetic có nồng độ từ 2% đến 5%. Axit axetic có công thức?
A. C2H5OH B. CH3COOH C. CH3OH D. HCHO
Câu 12. Trước kia thuốc trừ sâu 666 được sử dụng rộng rãi trong nền nông nghiệp nhưng do chất này có độc tính cao và phân hủy chậm nên đã bị cấm sử dụng tại 169 quốc gia tham gia công ước Stockholm. Chất được sử dụng làm thuốc trừ sâu 666 có công thức là
A. C2H2 B. C6H6Cl6 C. C4H6 D. C3H8
Câu 13. Cho phản ứng:
Xác định vai trò của CH3CHO trong phản ứng trên
A. Chất khử B. Axit C. Chất oxi hóa D. Bazơ
Câu 14. Để trung hòa hoàn toàn 6 gam axit axetic cần dùng V lít dung dịch NaOH 1M. Giá trị của V?
A. 0,05 lít B. 0,1 lít C. 0,2 lít D. 0,15 lít
Câu 15. Sản phẩm sinh ra trong thí nghiệm sau là gì?
A. CH3COOH B. (CH3CH2)2O C. CH3−CO−CH3 D. CH3CHO
Câu 16. Tính chất hóa học đặc trưng của ankan?
A. Phản ứng cộng B. Phản ứng trùng hợp
C. Phản ứng thế D. Phản ứng tách
Câu 17. Khí axetilen là nhiên liệu trong đèn xì oxi – axetilen đề hàn cắt kim loại vì phản ứng cháy của khí axetilen trong oxi tỏa ra lượng nhiệt rất lớn. Thể tích khí oxi (ở điều kiện tiêu chuẩn) cần để đốt cháy hết 1 mol khí axetilen là
A. 56 lít B. 112 lít C. 70 lít D. 65 lít
Câu 18. Dãy đồng đẳng của benzen (C6H6)có công thức phân tử chung là
A. CnH2n(n 2) B. CnH2n+2 (n 1)
C. CnH2n-6 (n 6) D. CnH2n-2 (n 2)
Câu 19. Phenol có công thức là
A. CH3OH B. CH3COOH C. C6H5OH D. C2H4
Câu 20. Ankađien là những hiđrocacbon mạch hở trong phân tử
A. Có 1 liên kết đôi C=C B. Chỉ có liên kết đơn
C. Có 2 liên kết đôi C=C D. Có 1 liên kết C C
Câu 21: Làm thí nghiệm như hình vẽ
Hiện tượng xảy ra trong ống nghiệm khi cho dư glixerol (C3H5(OH)3), lắc đều là gì?
A. Kết tủa tan, tạo dung dịch có màu xanh lam.
B. Không có hiện tượng gì.
C. Kết tủa vẫn còn, dung dich có màu trong suốt.
D. Kết tủa tan, dung dịch có màu nâu đỏ
Câu 22: Chất có công thức CH CH có tên gọi là
A. Etan. B. Metan. C. Etilen. D. Axetilen.
Câu 23: Đốt cháy hoàn toàn một ancol đơn chức (X) thu được 4,48 lít khí CO2 (đktc) và 4,5 gam H2O. Công thức của ancol (X) là
A. C3H7OH. B. C4H9OH. C. C2H5OH. D. CH3OH.
Câu 24: Thuốc thử để phân biệt hai khí but -2-in, but-1-in là
A. Dung dịch AgNO3 /NH3. B. Dung dịch KMnO4.
C. Dung dịch HCl. D. Dung dịch Br2.
Câu 25: Cho 0,94 gam phenol( C6H5OH) tác dụng vừa đủ với Vml dung dịch NaOH 1M. Giá trị của V là
A. 40ml B. 20ml C. 30ml D. 10ml
Câu 26: Dẫn 4,48 lít (đktc) hỗn hợp X gồm hai anken đồng đẳng kế tiếp qua bình đựng dung dịch brom dư thấy khối lượng bình sau phản ứng tăng thêm 7 gam. Biết các phản ứng xảy ra hoàn toàn. Công thức phân tử của 2 anken là
A. C4H8 và C5H10. B. C3H6 và C4H8.
C. C2H4 và C3H6. D. C5H10 và C6H12.
Câu 27: Metan là ankan có trong thành phần chính của khí thiên nhiên, khí biogas. Metan có công thức là
A. C2H6 B. C2H4 C. C2H2. D. CH4
Câu 28: Cho đốt cháy hết m gam hỗn hợp X các ancol trong dãy đồng đẳng thì thu được 11,2 lít khí CO2 ở đktc và 12,6 gam nước. Vậy m gam hỗn hợp X tác dụng với Na dư thì lượng khí H2 thoát ra là V lít(đktc). Giá trị lớn nhất của V là
A. 6,72. B. 2,24. C. 4,48. D. 3,36.
II. PHẦN TỤ LUẬN (3 ĐIỂM)
Câu 1: (1 điểm)
a. Gọi tên các hợp chất sau: CH3OH; CH3-CHO
b. Viết công thức cấu tạo thu gọn các hợp chất sau: axit fomic, butan-2-ol
Câu 2: (1 điểm) Bằng phương pháp hóa học hãy nhận biết các ống nghiệp đựng các dung dịch hóa chất sau: Axit axetic (CH3COOH), ancol etylic (C2H5OH), phenol (C6H5OH).
Câu 3: (0,5 điểm) Cho 9 gam một axit cacboxylic no, đơn chức, mạch hở tác dụng với natri dư thì thu được 1,68 lít khí H2 (đktc). Xác định công thức của axit cacboxylic?
Câu 4: (0,5 điểm) Cho sơ đồ phản ứng sau:
Metan X Y Z T
Xác định công thức các chất X, Y, Z, T và viết các phương trình (1), (2), (3), (4). Biết T là chất no đơn chức và có 4 nguyên tử cacbon trong phân tử
(Học sinh không được sử dụng tài liệu)
------ HẾT ------
ĐỀ SỐ 3
I. PHẦN TRẮC NGHIỆM (7 ĐIỂM)
Cho nguyên tử khối của các nguyên tố (đvC): H=1; He=4; C=12; N=14; O=16; Na=23; Mg=24; Al=27; P=31; S=32; Cl=35,5; K=39; Ca=40; Fe=56; Cu=64; Br=80; Ag=108; Ba=137;
Câu 1: Đun nóng butan-2-ol trong điều kiện H2SO4 đặc, 1700C tạo ra tối đa bao nhiêu anken là đồng phân của nhau (tính cả đồng phân hình học cis, trans)?
A. 3 B. 2 C. 1 D. 4
Câu 2: Metanol là một độc tố ngây chết người hàng đầu trong các vụ ngộ độc rượu. Công thức phân tử của metanol là
A. HCHO. B. C6H5OH. C. CH3OH. D. C6H5CH2OH.
Câu 3: Tên thay thế của ancol có công thức cấu tạo thu gọn CH3CH2CH2OH là
A. propan-2-ol. B. pentan-1-ol. C. pentan-2-ol. D. propan-1-ol.
Câu 4: Đun nóng một ancol đơn chức X thu được 14,8 gam ete và 3,6 gam H2O. Công thức ancol X là
A. C3H5OH. B. C3H7OH C. C4H7OH. D. C2H5OH.
Câu 5: Thủy phân chất X trong nước thu được khí metan. Vậy X là
A. Al4C3. B. CaO. C. Na. D. CaC2.
Câu 6: Cho 0,01 mol phenol (C6H5OH) tác dụng vừa đủ với dung dịch Br2 loãng thu được m gam kết tủa trắng là 2,4,6 -tribromphenol. Giá trị của m là
A. 3,31. B. 6,62 C. 9,93. D. 4,43.
Câu 7: Hỗn hợp E gồm ancol etylic và hai hiđrocacbon mạch hở thuộc cùng dãy đồng đẳng. Hóa hơi m gam E thu được thể tích bằng với thể tích của 0,96 gam khí O2 ở cùng điều kiện. Mặt khác đốt cháy m gam E cần vừa đủ 0,3 mol O2, sau phản ứng thu được 0,195 mol CO2. Khối lượng C2H5OH trong hỗn hợp hợp E là
A. 0,92 gam. B. 0,69 gam. C. 0,46 gam. D. 0,23 gam.
Câu 8: Chất nào mất màu dung dịch Br2 là
A. Benzen B. Hexan C. Etilen D. Metan
Câu 9: Công thức tổng quát của ancol no, đơn chức, mạch hở là
A. CnH2n-1OH. B. CnH2n+2-OH. C. CnH2n-2-OH. D. CnH2n+1-OH.
Câu 10: Cho 224 ml khí etilen ở đktc phản ứng vừa đủ với V ml dung dịch Br2 0,5M. Giá trị của V là
A. 10 B. 20. C. 40 D. 80
Câu 11: Cho 12 gam ancol X no, đơn chức, mạch hở phản ứng với Na (dư) thu được 2,24 lit khí H2 (đktc). Công thức phân tử của X là:
A. C3H7OH. B. C2H5OH. C. CH3OH. D. C4H9OH
Câu 12: Đun nóng 11,6 gam C4H10 một thời gian, thu được hỗn hợp X gồm chất: H2, CH4, C2H6, C4H8, C3H6, C2H4, C4H10. Đốt cháy hoàn toàn X rồi cho sảng phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư, thấy khối lượng bình tăng lên m gam. Giá trị của m là?
A. 80,0. B. 35,2. C. 18.0. D. 53,2.
Câu 13: Đốt cháy hoàn toàn một hiđrocacbon X thu được 6,72 lít CO2 (đktc) và 7,2 gam H2O. CTPT của X là:
A. C2H6 B. C3H8 C. C4H10 D. C3H6
Câu 14: Đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm các ankan thu được 0,35 mol CO2 và m gam H2O. Giá trị của m là
A. 8,1 B. 9,0 C. 4,5 D. 7,2
Câu 15: Dãy đồng đẳng của axetilen hay ankin có công thức chung là
A. CnH2n+2 (n ≥ 2) B. CnH2n (n ≥ 2)
C. CnH2n-2 (n ≥ 2) D. CnH2n-6 (n ≥ 6)
Câu 16: Số đồng phân cấu tạo ancol ứng với công thức phân tử C4H10O là
A. 5. B. 3. C. 4. D. 2.
Câu 17: Ancol X là một ancol khi đốt cháy m gam thu được a mol CO2, còn nếu cho 2 m gam X tác dụng với Na dư thấy cũng thu được a mol khí H2. Vậy X là
A. Ancol etylic. B. Glixerol.
C. Ancol benzylic. D. Propan – 1,2 – điol.
Câu 18: Chất không tham gia phản ứng cộng với H2( Ni, t0) là
A. CH CH B. CH3-CH3
C. CH2=CH2 D. CH2=CH-CH=CH2
Câu 19: Cho 1 mẩu Na nhỏ bằng hạt đậu vào ống nghiệm chứa 2 - 3 ml chất lỏng X, thấy giải phóng khí Y. Đốt cháy Y trong không khí, thấy Y cháy với ngọn lửa màu xanh nhạt. Chất X là
A. benzen. B. Đietyl ete. C. Hexan. D. Etanol.
Câu 20: Nhỏ dung dịch Br2 loãng vào dung dịch chứa chất X nhận thấy nước brom mất màu, đồng thời có kết tủa trắng xuất hiện. Vậy X là
A. C2H5OH B. C6H5OH
C. C6H5-CH=CH2 D. CH3COOH
Câu 21: Phenol (C6H5OH) không phản ứng với chất nào sau đây?
A. Na. B. NaOH.
C. Dung dịch HCl. D. Dung dịch Br2.
Câu 22: Xăng sinh học E5 đang được khuyến khích người tiêu dùng sử dụng, là loại xăng có chứa 5% về thể tích etanol. Etanol là tên gọi của chất nào?
A. CH3OH. B. CH3CHO. C. C3H8O3. D. C2H5OH.
Câu 23: Đun nóng ancol etylic với H2SO4 đặc ở 170°C, thu được một hiđrocacbon có công thức là
A. C2H2. B. C2H6. C. C2H4. D. CH4.
Câu 24: Chất có hai liên kết đôi trong phân tử là?
A. CH2=CH-CH=CH2 B. CH2=CH-C CH
C. CH2=CH2 D. CH3-CH2- C CH
Câu 25: Ankan X có tỷ khối hơi so với H2 là 29. Vậy công thức của X là
A. C4H10 B. C4H8 C. C2H6 D. C3H8
Câu 26: Công thức CH¬2=CH2 có tên gọi là
A. Propilen. B. Etilen. C. Etan. D. Axetilen.
Câu 27: Khi cho 4,6 gam ancol etylic tác dụng hết với Na dư, thu được V lít khí H2 (đktc). Giá trị của V là
A. 4,48 lít. B. 1,12 lít. C. 3,36 lít. D. 2,24 lít.
Câu 28: Dẫn khí X đi qua dung dịch AgNO3/NH3 nhận thấy có kết tủa vàng nhạt xuất hiện. Vậy X là
A. CH CH B. CH2=CH2 C. CH4 D. CH3-CH3
II. PHẦN TỤ LUẬN (3 ĐIỂM)
Câu 1: (1 điểm)
Hoàn thành các phương trình hóa học sau
a) C6H5OH + NaOH b) CH3COOH + Na2CO3
c) C2H5OH + O2(dư) d) CH2=CH2 + HCl
Câu 2: (1 điểm) Bằng phương pháp hóa học hãy nhận biết các ống nghiệp đựng các dung dịch hóa chất sau: Axit axetic (CH3COOH), ancol etylic (C2H5OH), phenol (C6H5OH).
Câu 3: (0,5 điểm) : Đốt cháy hoàn toàn hỗn hợp các anken bằng oxi thu được 7,84 lít CO2(đktc) và m gam H2O. Giá trị của m là bao nhiêu?
Câu 4: (0,5 điểm) Đun nóng 11,6 gam C4H10 một thời gian, thu được hỗn hợp X gồm chất: H2, CH4, C2H6, C4H8, C3H6, C2H4, C4H10. Đốt cháy hoàn toàn X rồi cho sảng phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư, thấy khối lượng bình tăng lên m gam. Giá trị của m là?
(Học sinh không được sử dụng tài liệu)
------ HẾT ------
ĐỀ THAM KHẢO HÓA 12
ĐỀ 1
PHẦN TRẮC NGHIỆM: 7,0 điểm
Câu 1: Để điều chế kim loại kiềm, người ta dùng phương pháp nào sau đây?
A. Điện phân nóng chảy. B. Điện phân dung dịch. C. Thủy luyện. D. Nhiệt luyện.
Câu 2: Trong các hợp chất, K có số oxi hóa là
A. 0 và +1. B. +1. C. +1 và +2. D. +1 và -1.
Câu 3: Dung dịch thu được khi hòa tan kim loại Na vào nước là
A. NaOH. B. Na(OH)2. C. Na(OH)3. D. Na2O .
Câu 4: Kim loại nào sau đây là kim loại kiềm thổ?
A. Na. B. Fe. C. Ca. D. Cu.
Câu 5: Kim loại nào sau đây không tan trong nước ở bất kì nhiệt độ nào?
A. Ba. B. Ca. C. Mg. D. Be.
Câu 6: Công thức hóa học của thạch cao sống là
A. CaSO4.2H2O. B. CaSO4. C. CaSO4.3H2O. D. CaSO4.5H2O.
Câu 7: Nước cứng là nước có chứa nhiều ion
A. Mg2+, Ca2+. B. Ba2+, Mg2+. C. Cu2+, Mg2+. D. Na+, Ca2+.
Câu 8: Phèn chua được dùng trong ngành thuộc da, công nghiệp giấy, chất cầm màu trong công nghiệp nhuộm, chất làm trong nước. Công thức hóa học của phèn chua là
A. KAl(SO4)2.12H2O. B. NaAl(SO4)2.12H2O. C. NH4Al(SO4)2.12H2O. D. LiAl(SO4)2.12H2O.
Câu 9: Quặng nào sau đây dùng để sản xuất nhôm?
A. Boxit. B. Đolomit. C. Apatit. D. Pirit.
Câu 10: Tính chất vật lý nào dưới đây không phải của Fe?
A. Kim loại nặng, khó nóng chảy. B. Dẫn điện và dẫn nhiệt tốt.
C. Màu vàng nâu, dẻo, dễ rèn. D. Có tính nhiễm từ.
Câu 11: Fe phản ứng với dung dịch nào sau đây tạo khí H2?
A. H2SO4 loãng. B. HNO3. C. CuSO4. D. AgNO3.
Câu 12: Trong các loại quặng sắt, quặng có hàm lượng sắt cao nhất là
A. hematit nâu. B. manhetit. C. xiđerit. D. hematit đỏ.
Câu 13: Gang là hợp kim của
A. sắt với cacbon. B. sắt với photpho. C. sắt với lưu huỳnh. D. sắt với nhôm.
Câu 14: Các số oxi hóa thường gặp của Cr trong hợp chất là:
A. +1, +2, +6. B. +3, +4, +6. C. +2, +3, +6. D. +2, +4, +6.
Câu 15: Chất nào sau đây là oxit axit?
A. CrO3. B. FeO. C. Cr2O3. D. Fe2O3.
Câu 16: Tác nhân nào sau đây là nguyên nhân chính gây ra mưa axit?
A. NO2, SO2. B. SO3, CO2. C. CO2, NO2. D. N2, H2.
Câu 17: Khối lượng quặng boxit chứa 75% Al2O3 cần để sản xuất 1,5 tấn nhôm nguyên chất là (biết hiệu suất phản ứng điện phân đạt 90%)
A. 7,6 tấn. B. 8,4 tấn. C. 4,2 tấn. D. 3,8 tấn.
Câu 18: Hiện tượng xảy ra khi cho kim loại Na vào dung dịch CuSO4 là
A. sủi bọt khí không màu và có kết tủa màu xanh.
B. bề mặt kim loại có màu đỏ, dung dịch nhạt màu.
C. sủi bọt khí không màu và có kết tủa màu đỏ.
D. bề mặt kim loại có màu đỏ và có kết tủa màu xanh.
Câu 19: Nung hỗn hợp gồm MgCO3 và BaCO3 có cùng số mol đến khối lượng không đổi thu được khí X và chất rắn Y. Hòa tan Y vào nước dư, lọc bỏ kết tủa thu được dung dịch Z. Hấp thụ hoàn toàn khí X vào dung dịch T, sản phẩm sau phản ứng là
A. Ba(HCO3)2. B. BaCO3 và Ba(HCO3)2.
C. BaCO3 và Ba(OH)2. D. BaCO3.
Câu 20: Cho mẫu kim loại Mg vào dung dịch HNO3 loãng, sau phản ứng chỉ thu được dung dịch X. Muối có trong dung dịch X là
A. Mg(NO3)2. B. NH4NO3. C. Mg(NO3)2, NH4NO3. D. Mg(NO3)2, NH4NO2.
Câu 21: Dung dịch chất nào sau đây không thể hòa tan Al2O3?
A. NaOH. B. H2SO4. C. NH3. D. Ba(OH)2.
Câu 22: Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là
A. có kết tủa keo trắng và có khí thoát ra. B. có kết tủa keo trắng, sau đó kết tủa tan.
C. không có kết tủa, có khí thoát ra. D. chỉ có kết tủa keo trắng.
Câu 23: Hoà tan hoàn toàn m gam Fe trong dung dịch HNO3 loãng dư, sau khi phản ứng kết thúc thu được 0,448 lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A.11,2. B. 0,56. C. 5,60. D. 1,12.
Câu 24 :Hợp chất FeO thể hiện tính khử trong phản ứng với chất nào sau đây?
A. Dung dịch HNO3. B. Dung dịch HCl.
C. CO. D. Dung dịch H2SO4 loãng.
Câu 25 : Phương trình hóa học nào sau đây không đúng?
A. 2Cr + 3H2SO4 (loãng) Cr2(SO4)3 + 3H2.
B. 2Cr + 3Cl2 2CrCl3.
C. Cr(OH)3 + 3HCl CrCl3 + 3H2O.
D. Cr2O3 + 2NaOH (đặc) 2NaCrO2 + H2O.
Câu 26 : Cho các phát biểu sau:
(a) Lưu huỳnh, photpho, cacbon đều phản ứng với CrO3.
(b) Bột nhôm dễ phản ứng với khí Cl2.
(c) Phèn chua có công thức là KAl(SO4)2.12H2O.
(d) Cr2O3 là oxit lưỡng tính.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
Câu 27 : Hòa tan hoàn toàn hỗn hợp X gồm 0,02 mol Cr và 0,03 mol Fe trong trong dung dịch H2SO4 loãng dư thu được V lít H2 (đktc). Giá trị của V là
A. 1,120. B. 2,240. C. 0,448. D. 0,672.
Câu 28 : Cho các phát biểu sau:
(a) Trong tự nhiên, kim loại kiềm chỉ tồn tại dạng hợp chất.
(b) Al tác dụng mạnh với dung dịch HNO3 đặc nóng và H2SO4 đặc nóng.
(c) Có thể dùng dung dịch Na2CO3 để làm mềm nước cứng tạm thời.
(d) Hỗn hợp Cu và Fe2O3 với tỷ lệ mol 1 : 1 có thể tan hết trong nước dư.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
PHẦN TỰ LUẬN: 3,0 điểm
Câu 29 (1 điểm): Viết phương trình hóa học điều chế kim loại Ca từ CaCO3.
Câu 30 (1 điểm): Hòa tan hết 7,3 gam hỗn hợp bột Na, Al vào nước thu được 5,6 lít H2 (đktc).
a. Viết phương trình hóa học của các phản ứng xảy ra.
b. Tính phần trăm khối lượng của mỗi kim loại trong hỗn hợp.
Câu 31 (0,5 điểm): Hòa tan hoàn toàn 5,584 gam hỗn hợp Fe và Fe3¬O4 vào dung dịch HNO3 loãng, dư. Sau khi phản ứng hoàn toàn thu được 0,3136 lít khí NO (đktc, sản phẩm khử duy nhất của N+5) và dung dịch X chứa m gam muối. Tính giá trị m.
Câu 32 (0,5 điểm): Xác định các chất X, Y và viết phương trình hóa học của các phản ứng trong sơ đồ chuyển hóa sau:
NaOH X Y NaOH
------------------ Hết -----------------
ĐỀ 2
PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1. Kim loại nào sau đây được điều chế bằng phương pháp điện phân dung dịch?
A. Ba. B. Ag. C. Na. D. Ca.
Câu 2: Trong các hợp chất, Na có số oxi hóa là
A. 0 và +1. B. +1. C. +1 và +2. D. +1 và -1.
Câu 3: Natrihidrocacbonat có công thức phân tử là
A. NaOH. B. NaHCO3. C. NaCl. D. Na2SO4.
Câu 4: Trong bảng tuần hoàn, các kim loại kiềm thuộc nhóm
A. IA. B. IIA. C. IIIA. D. VA.
Câu 5: Sản phẩm thu được khi đốt Mg trong bình đựng khí clo là
A. MgCl2. B. MgCl. C. MgCl3. D. MgO.
Câu 6: Công thức hóa học của thạch cao nung là
A. CaSO4.2H2O. B. 2CaSO4.H2O. C. CaSO4.3H2O. D. CaSO4.
Câu 7: Cách làm mềm nước cứng tạm thời nào sau đây là đơn giản nhất?
A. Đun sôi B. Dùng dung dịch HCl loãng. C. Dùng dung dịch Na2CO3. D. Dùng dung dịch nước vôi trong.
Câu 8: Kim loại Al không có tính chất vật lí nào sau đây?
A. Dễ dát mỏng. B. Khối lượng riêng lớn C. Màu trắng bạc. D. Khá mềm.
Câu 9: Ứng dụng nào sau đây không đúng với nhôm và hợp kim của nhôm?
A. Hàn đường ray. B. Dụng cụ nhà bếp C. Chế tạo máy bay, ô tô, tên lửa. D. Dụng cụ y tế
Câu 10: Cấu hình electron nào sau đây là của ion Fe3+?
A. [Ar]3d6. B. [Ar]3d5. C. [Ar]3d4. D. [Ar]3d3.
Câu 11: Phương trình hóa học nào sau đây đúng?
A. Fe + H2SO4 → FeSO4 + H2. B. 2Fe + 6HCl → 2FeCl3 + 3H2.
C. Fe + 3AgNO3 → Fe(NO3)3 + 3Ag. D. Fe + Cl2 → FeCl2.
Câu 12: Công thức hóa học của sắt(II) clorua là
A. FeCl2. B. Fe(OH)3. C. FeSO4. D. Fe2O3.
Câu 13: Phát biểu nào sau đây không đúng?
A. Nguyên liệu sản xuất gang gồm quặng sắt, than cốc và chất chảy.
B. Chất khử trong quá trình sản xuất gang là cacbon monooxit.
C. Thép là hợp kim của sắt, chứa từ 0,01-2% khối lượng cacbon, ngoài ra còn có một số nguyên tố khác.
D. Để chuyển hóa gang thành thép có thể dùng bột nhôm để khử oxit sắt.
Câu 14: Trong các kim loại: Fe, Al, Na, Cr, kim loại cứng nhất là
A. Fe. B. Au. C. W. D. Cr.
Câu 15: Hợp chất nào sau đây có tính lưỡng tính?
A. CrCl3. B. NaOH. C. KOH D. Cr(OH)3.
Câu 16: Chất bột được dùng để khử tính độc của thuỷ ngân là
A. vôi sống. B. cát. C. lưu huỳnh. D. muối ăn.
Câu 17: Nguyên tắc chung để điều chế kim loại là
A. khử ion kim loại thành kim loại. B. oxi hóa kim loại thành ion kim loại.
C. oxi hóa ion kim loại thành kim loại. D. khử ion kim loại thành nguyên tử.
Câu 18: Cho 2,34 gam kim loại M thuộc nhóm IA phản ứng với H2O thu được 0,672 lit khí H2 (đktc) . Kim loại M là
A. K. B. Na. C. Li. D. Ag.
Câu 19: Dãy chất nào sau đây đều tác dụng với dung dịch Ca(OH)2?
A. Ca(HCO3)2, Na2CO3. B. MgO, HCl. C. NaHCO3, NaCl. D. Mg(OH)2, HCl.
Câu 20: Ứng dụng nào sau đây không phải của CaCO3?
A. Làm vôi quét tường. B. Làm vật liệu xây dựng.C. Sản xuất ximăng D. Sản xuật bột nhẹ để pha sơn.
Câu 21: Nhóm gồm tất cả các chất vừa tác dụng với dung dịch NaOH, vừa tác dụng với dung dịch HCl là
A. AlCl3, Al(OH)3. B. NaAlO2, Al2O3. C. Al2O3, Al(OH)3. D. Al2(SO4)3, NaAlO2.
Câu 22: Cho m gam Al phản ứng vừa đủ với 0,039 mol Cl2. Giá trị của m là
A. 1,053. B. 0,702. C. 0,175. D. 0,351.
Câu 23: Hòa tan 5,6 gam Fe trong lượng dư dung dịch HNO3 đặc nóng thấy thoát ra V lít khí NO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
A. 2,240. B. 4,480. C. 6,720. D. 8,960.
Câu 24: Thí nghiệm nào sau đây thu được muối sắt (III)?
A. Cho Fe(OH)2 vào dung dịch H2SO4 loãng. B. Cho Fe dư vào dung dịch Fe(NO3)3.
C. Cho Fe vào dung dịch HNO3 loãng, dư. D. Cho FeO vào dung dịch HCl.
Câu 25: Dung dịch X có màu đỏ cam. Nếu cho thêm vào một lượng KOH, màu đỏ của dung dịch dần dần chuyển sang màu vàng tươi. Nếu thêm vào đó một lượng H2SO4, màu của dung dịch dần dần trở lại đỏ cam. Dung dịch X là
A. K2Cr2O7. B. K2Cr2O4. C. KCr2O4. D. KMnO4.
Câu 26: Cho các phát biểu sau:
(1) Dẫn CO2 dư vào dung dịch Ca(OH)2, kết thúc phản ứng thu được kết tủa.
(2) Crom là kim loại có tính khử mạnh hơn sắt.
(3) Nhỏ đến dư dung dịch NH3 vào dung dịch AlCl3 thấy xuất hiện kết tủa.
(4) CaSO4.H2O được dùng để bó bột, nặng tượng và đúc khuôn.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 27: Thí nghiệm nào sau đây không thu được kết tủa?
A. Cho dung dịch KOH vào dung dịch FeCl3.
B. Cho dung dịch AgNO3 vào dung dịch Na3PO4.
C. Cho dung dịch NaOH dư vào dung dịch Al(NO3)3.
D. Cho dung dịch BaCl2 vào dung dịch K2SO4.
Câu 28: Cho các thí nghiệm sau (các phản ứng xảy ra hoàn toàn):
(a) Cho hỗn hợp Na và Al (tỉ lệ mol 3:1) vào nước dư;
(b) Cho hỗn hợp BaO và NH4Cl (tỉ lệ mol 1:2) vào nước dư;
(c) Cho Mg vào dung dịch HNO3 loãng dư, không có khí thoát ra;
(d) Sục khí CO2 dư vào dung dịch Ba(OH)2;
(e) Cho 1,2x mol Fe vào dung dịch chứa 4x mol HNO3 đun nóng (NO là sản phẩm khử duy nhất).
Số thí nghiệm thu được dung dịch chứa hai chất tan là
A. 4. B. 2. C. 5. D. 3.
PHẦN TỰ LUẬN:
Câu 29 (1,0 điểm): Viết phương trình hóa học các phản ứng trong sơ đồ chuyển hóa sau:
Fe FeBr3 Fe(OH)3¬ Fe2O3 Fe3O4
Câu 20 (1,0 điểm): Cho m gam hỗn hợp X gồm Al và Cr tác dụng với dung dịch HCl loãng, nóng dư thu được 10,08 lít H2 (đktc). Cũng lượng hỗn hợp X trên tác dụng với lượng dư dung dịch NaOH thu được 6,72 lít H2 (đktc).
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính m.
Câu 31 (0,5 điểm): Có 4 mẫu bột kim loại: K, Al, Fe, Ca. Chỉ dùng nước làm thuốc thử, trình bày cách nhận biết 4 kim loại trên.
Câu 32 (0,5 điểm): Cho một luồng khí CO đi qua ống sứ đựng 0,04 mol hỗn hợp A gồm FeO và Fe2O3 đốt nóng. Sau khi kết thúc thí nghiệm thu được hỗn hợp B gồm bốn chất nặng 4,784 gam. Khí đi ra khỏi ống sứ cho hấp thụ vào dung dịch Ba(OH)2 dư tạo thành 9,062 gam kết tủa.Tính thành phần phần trăm của khối lượng của từng chất trong hỗn hợp A.
ĐỀ 3
PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1. Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
A. Ag. B. Na. C. Fe. D. Cu.
Câu 2. Ở nhiệt độ thường, kim loại Na phản ứng với H2O, thu được H2 và chất nào sau đây?
A. NaCl. B. Na2O. C. NaOH. D. Na2O2.
Câu 3. Kim loại nào sau đây là kim loại kiềm?
A. Ca. B. K. C. Cu. D. Al.
Câu 4. Khi so sánh với kim loại kiềm cùng chu kì, nhận xét nào dưới đây đúng về kim loại kiềm thổ?
A. Khối lượng riêng nhỏ hơn. B. Độ cứng lớn hơn.
C. Nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn. D. Thế điện cực chuẩn nhỏ hơn.
Câu 5. Để phân biệt dung dịch CaCl2 với dung dịch NaCl, người ta dùng dung dịch
A. HNO3. B. Na2CO3. C. NaNO3. D. KNO3.
Câu 6. Nước cứng là nước
A. chứa nhiều ion Ca2+ , Mg2+. B. chứa một lượng cho phép Ca2+ , Mg2+.
C. không chứa Ca2+ , Mg2+ D. chứa nhiều Ca2+ , Mg2+ , HCO3-.
Câu 7. Thạch cao nung có công thức hóa học là
A. CaCO3. B. CaSO4.2H2O. C. CaSO4. D. CaSO4.H2O.
Câu 8. Phát biểu nào sau đây không đúng với nhôm?
A. Ở ô thứ 12, chu kì 3, nhóm IIIA. B. Cấu hình electron nguyên tử: [Ne] 3s23p1.
C. Mức oxi hóa đặc trưng trong hợp chất là +3. D. Có 3 electron ở lớp ngoài cùng.
Câu 9. Sản phẩm của phản ứng nhiệt nhôm luôn có
A. Al. B. Al(OH)3. C. Al2O3. D. O2.
Câu 10. Cấu hình electron nào sau đây là của Fe?
A. [Ar] 4s23d6. B. [Ar]3d64s2. C. [Ar]3d8. D. [Ar]3d74s1.
Câu 11. Tính chất vật lý nào sau đây của sắt khác với các đơn chất kim loại khác?
A. Tính dẻo, dễ rèn. B. Có tính nhiễm từ. C. Dẫn điện và nhiệt tốt. D. Là kim loại nặng.
Câu 12. Phát biểu nào không đúng?
A. Gang là hợp chất Fe-C. B. Hàm lượng C trong gang nhiều hơn trong thép.
C. Gang là hợp kim Fe-C và 1 số nguyên tố khác. D. Gang trắng chứa ít C hơn gang xám.
Câu 13. Sắt(III) oxit có công thức hóa học là
A. Fe2O3. B. FeO. C. Fe3O4. D. Fe(OH)2.
Câu 14. Oxit lưỡng tính là
A. Cr2O3. B. MgO. C. CrO. D. CaO.
Câu 15. Các số oxi hoá đặc trưng của crom trong hợp chất là:
A. +2, +4, +6. B. +2, +3, +6. C. +1, +2, +4, +6. D. +3, +4, +6.
Câu 16. Chất khí nào sau đây là một trong các nguyên nhân gây ra hiệu ứng nhà kính?
A. SO2. B. CO2. C. NH3. D. N2.
Câu 17. Khi điều chế kim loại các ion kim loại đóng vai trò là chất
A. cho electron. B. bị khử. C. nhận proton. D. bị oxi hoá.
Câu 18. Kim loại kiềm có nhiệt độ nóng chảy thấp là do
A. khối lượng riêng nhỏ. B. tính khử của kim loại mạnh.
C. bán kính nguyên tử lớn. D. lực liên kết kim loại trong mạng tinh thể kém bền.
Câu 19. Trong các kim loại kiềm thổ: Mg, Ca, Sr, Ba. Kim loại có tính khử mạnh nhất là
A. Sr. B. Ca. C. Ba. D. Mg.
Câu 20. Sục 6,72 lít khí CO2 (đktc) vào dung dịch Ca(OH)2 dư. Kết thúc phản ứng khối lượng kết tủa thu được là
A. 15 gam. B. 25 gam. C. 20 gam. D. 30 gam.
Câu 21. Nhôm hiđroxit không phản ứng được với chất nào sau đây?
A. Dung dịch KOH. B. Dung dịch H2SO4. C. Dung dịch H2SO4 đặc nguội. D. Dung dịch NH3¬.
Câu 22. Cho các chất: Al, Al2O3, AlCl3, Al(OH)3. Số chất phản ứng được với dung dịch HCl là
A. 2. B. 3. C. 1. D. 4.
Câu 23. Cho Fe dư vào dung dịch H2SO4 loãng thu được 6,72 lít khí (ở điều kiện tiêu chuẩn). Khối lượng Fe tham gia phản ứng là
A. 16,8 gam. B. 5,6 gam. C. 25,2 gam. D. 11,2 gam.
Câu 24. Dãy gồm hai chất chỉ có tính oxi hoá là
A. Fe(NO3)2, FeCl3. B. Fe(OH)2, FeO. C. Fe2O3, Fe2(SO4)3. D. FeO, Fe2O3.
Câu 25. Chất rắn màu lục, tan trong dung dịch HCl được dung dịch A. Cho A tác dụng với NaOH và brom được dung dịch màu vàng, thêm tiếp H2SO4 vào thì thu được dung dịch có màu da cam. Chất rắn đó là
A. Cr2O3. B. CrO. C. CrO3. D. Cr.
Câu 26. Cho các phát biểu sau:
(1) Lưu huỳnh, photpho, cacbon đều phản ứng với CrO3;
(2) Bột nhôm dễ phản ứng với khí Cl2;
(3) Phèn chua có công thức là KAl(SO4)2.12H2O;
(4) Cr2O3 là oxit lưỡng tính.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
Câu 27. Ứng dụng nào sau đây không đúng?
A. Khi nghiền clanhke, trộn thêm thạch cao để điều chỉnh tốc độ đông cứng của xi măng.
B. Đá vôi được dùng làm vật liệu xây dựng, sản xuất vôi, xi măng, …
C. Khi nung nóng, thạch cao sống bị mất nước tạo thành thạch nhũ trong các hang động.
D. Vôi tôi được sử dụng rộng rãi trong công nghiệp và nông nghiệp.
Câu 28. Trường hợp nào sau đây thu được kết tủa sau khi phản ứng xảy ra hoàn toàn?
A. Sục khí CO2 dư vào dung dịch Ca(OH)2.
B. Cho dung dịch NaOH dư vào dung dịch HCl.
C. Cho dung dịch Na3PO4 vào dung dịch Ca(HCO3)2.
D. Cho CaCO3 vào dung dịch HCl loãng, dư.
PHẦN TỰ LUẬN.
Câu 29 (1 điểm): Cho m gam hỗn hợp X gồm Al, Cr tác dụng với lượng dư dung dịch HCl loãng nóng dư không có không khí, thu được 1,456 lít khí H2 (ở đktc). Cũng m gam hỗn hợp X tác dụng với lượng dư dung dịch NaOH đặc thu được 1,008 lít khí H2 (ở đktc).
a) Viết phương trình hóa học của các phản ứng xảy ra?
b) Tính m?
Câu 30 (1 điểm): Hoàn thành sơ đồ chuyển hóa sau:
Ca(OH)2 NaOH Fe(OH)3¬ Fe2O3 Al2O3
Câu 31 (0,5 điểm):Cho các dung dịch đựng riêng biệt trong các lọ mất nhãn sau: NH4Cl, NaCl, BaCl2, Na2CO3. Chỉ dùng thêm một thuốc thử, trình bày cách nhận biết 4 chất trên? Viết các phương trình hóa học của các phản ứng xảy ra(nếu có)?
Câu 32 (0,5 điểm): Hoà tan 5 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ thu được 0,56 lít khí H2 ở đktc và dung dịch A.
a) Tính % khối lượng mỗi chất trong hỗn hợp ban đầu?
b) Cho dung dich A tác dụng với dung dịch NaOH dư. Lấy kết tủa nung trong không khí đến khối lượng không đổi được m gam chất rắn X.(Biết hiệu suất các phản ứng là 100%). Tính m?
ĐỀ THAM KHẢO HÓA 10
ĐỀ THAM KHẢO KIỂM TRA HỌC KỲ 2 |
Môn: Hoá học - Lớp 10 |
Thời gian: 45 phút ĐỀ THAM KHẢO SỐ 1
|
I–Trắc nghiệm
|
|
|
| Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là: A. ns2np3 B. ns2np4 C. ns2np5 D. ns2np6 |
|
| Chất X là chất khí ở điều kiện thường, có màu vàng lục, dùng để khử trùng nước sinh hoạt… Chất X là: A. O2 B. Cl2 C. SO2 D. O3 |
|
| Cho 15,8 gam KMnO4 tác dụng hoàn toàn với HCl đặc, dư. Thể tích khí thu được ở (đktc) là: A. 5,6 lít B.3,36 lít C. 2,24 lít D. 1,12 lít |
|
| Cho lần lượt các chất sau: Cu, C, MgO, KBr, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3 tác dụng với dung dịch H2SO4 đặc, nóng. Số phản ứng oxi hoá - khử là: A. 9 B. 8 C. 7 D. 6 |
|
| Thuốc thử có thể dùng để phân biệt được cả 4 lọ KF, KCl, KBr, KI là AgNO3 B. NaOH C. quỳ tím D. Cu
|
|
| Có 3 bình đựng 3 chất khí riêng biệt: O2, O3, H2S lần lượt cho từng khí này qua dung dịch KI có pha thêm hồ tinh bột, chất khí làm dung dịch chuyển màu xanh là : A. O2 B. H2S C. O3 D. O3 và O2 |
|
| Có 4 dd sau đây: HCl , Na2SO4 , NaCl , Ba(OH)2 . Chỉ dùng thêm 1 hóa chất nào sau đây để phân biệt được 4 chất trên? A. Na2SO4. B. Phenolphtalein. C. dd AgNO3 . D. Quỳ tím |
|
| Cu kim loại có thể tác dụng với chất nào trong các chất sau? A. Khí Cl2. B. Dung dịch HCl. C. Dung dịch KOH đặc D. Dung dịch H2SO4 loãng. |
|
| Dẫn khí clo qua dung dịch NaOH ở nhiệt độ phòng, muối thu được là: A. NaCl, NaClO3 B. NaCl, NaClO C. NaCl, NaClO4 D. NaClO, NaClO3 |
|
| Dãy chất nào sau đây vừa có tính oxi hoá, vừa có tính khử? A. O2 , Cl2 , H2S. B. S, SO2 , Cl2 C. F2, S , SO3 D. Cl2 , SO2, H2SO4 |
|
| Dãy chất tác dụng được với dung dịch H2SO4 đặc nguội là: A. CaCO3, Al, CuO B. Cu, MgO, Fe(OH)3 C. S, Fe, KOH D. CaCO3, Au, NaOH |
|
| Dung dịch axit HCl tác dụng được với dãy chất nào sau đây: A. Zn, CuO, S. B. Fe, Au, MgO C. CuO, Mg, CaCO3 D. CaO, Ag, Fe(OH)2 |
|
| Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng: A. Xuất hiện chất rắn màu đen B. Chuyển sang màu nâu đỏ C. Vẫn trong suốt, không màu D. Bị vẩn đục, màu vàng. |
|
| Hấp thụ 6,72 lít khí SO2 (đktc) vào 250 ml dung dịch NaOH 2M. Dung dịch sau phản ứng chứa: A. NaHSO3 1,2M. B. Na2SO3 1M . C. NaHSO3 0,4M và Na2SO3, 0,8M. D. NaHSO3 0,5M và Na2SO3, 1M. |
|
| Hòa tan 10,8 gam một kim loại R có hóa trị không đổi vào dung dịch HCl loãng dư thu được 10,08 lít H2 (ở đktc). Kim loại R là: A. Mg B. Fe C. Zn D. Al |
|
| Hòa tan hết m gam hỗn hợp CuO, MgO, Fe2O3 vào 400 ml dung dịch axit HCl 3M vừa đủ. Cô cạn dung dịch sau phản ứng thu được 65 gam muối khan. Tính m? A. 22,4 g B. 32,0 g C. 21,2 g D. 30,2 g |
|
| Oxi hóa 16,8 gam sắt bằng V lít không khí (ở đktc) thu được m gam chất rắn A gồm (Fe, FeO, Fe2O3, Fe3O4). Hòa tan hết A bằng dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 sản phẩm khử duy nhất. Tính V (Biết các khí đo ở đktc và O2 chiếm 1/5 thể tích không khí). A. 33,6 lit B. 11,2 lít C. 2,24 lít D. 44,8 lít |
|
| Phương pháp để điều chế khí O2 trong phòng thí nghiệm là: A. Điện phân H2O B. Chưng cất phân đoạn không khí lỏng C. Nhiệt phân KMnO4 D. Điện phân dung dịch NaCl |
|
| Thuốc thử để phân biệt 2 bình đựng khí H2S, O2 là: A. Dd HCl B. Dd KOH C. Dd NaCl D. Dd Pb(NO3)2 |
|
| Trộn 100 ml dung dịch H2SO4 2M và 208g dung dịch BaCl2 15% thì khối lượng kết tủa thu được là: A. 58,25g B. 23,30g C. 46,60g D. 34,95g. |
|
ĐỀ THAM KHẢO SỐ 2
Câu 1: Muốn pha loãng dung dịch axit H2SO4 đặc cần phải:
A. Rót từ từ nước vào dung dịch axit đặc. B. Rót từ từ dung dịch axit đặc vào nước
C. Rót nhanh dung dịch axit vào nước D. Rót nước thật nhanh vào dung dịch axit đặc
Câu 2: Cho các yếu tố sau:
a. áp suất b. xúc tác c. nồng độ chất. d. nhiệt độ e. diện tích tiếp xúc.
Những yếu tố ảnh hưởng đến tốc độ phản ứng nói chung là:
A.a, b, c, d. B. b, c, d, e. C. a, c, e. D. a, b, c, d, e.
Câu 3: Trong phòng thí nghiệm, người ta thường điều chế khí Clo bằng cách:
A. Điện phân dung dịch NaCl có màng ngăn B. Điện phân nóng chảy NaCl
C. Cho F2 đẩy Cl2 khỏi dung dịch NaCl D. Cho dung dịch HCl đặc tác dụng với MnO2
Câu 4: Lưu huỳnh có các mức oxi hóa là
A. -2, 0, +4, +6 B. -1; 0; +1; +3; +5; +7 C. +1; +3; +5; +7 D. -2; 0; +6; +7
Câu 5: Cho phản ứng hóa học SO2 + Br2 + H2O → HBr + H2SO4. Hệ số cân bằng của phản ứng trên lần lượt là?A. 2,1,2,1,2 B. 2,2,1,1,2 C. 1,1,2,2,1 D. 1,2,1,2,1
Câu 6: Thuốc thử có thể dùng để phân biệt được cả 4 lọ KF, KCl, KBr, KI là
A. AgNO3 B. NaOH C. quỳ tím D. Cu
Câu 7: Nước Gia-ven được điều chế bằng cách
A. Cho clo tác dụng với nước B. Cho clo sục vào dung dịch NaOH
C. Cho clo sục vào dung dịch KOH đặc nóng D. Cho clo tác dụng với Ca(OH)2
Câu 8: Nước clo hoặc khí clo ẩm có tính tẩy màu (tẩy trắng) vì nguyên nhân là :
A. Clo hấp thụ màu B. Nước clo chứa HClO có tính oxi hóa mạnh, tẩy màu
C. Clo tác dụng với nước tạo ra HCl có tính tẩy màu D. Tất cả đều đúng
Câu 9: Để phân biệt được 3 chất khí : CO2, SO2 và O2 đựng trong 3 bình mất nhãn riêng biệt , người ta dùng thuốc thử là:
A. Dung dịch Br2 B. Nước vôi trong (dd Ca(OH)2) và dung dịch Br2
C. Nước vôi trong (dd Ca(OH)2) D. Dung dịch KMnO4
Câu 10: Cho 16,25 gam một kim loại M hoá trị II tác dụng vừa đủ với 250ml dung dịch HCl 2M. Kim loại M là:A. Al B. Cu C. Zn D. Mg
Câu 11: Kim loại nào dưới đây có phản ứng với axit H2SO4 đặc, nguội?
A. Fe B. Al C. Zn D. Cr
Câu 12: Cho các chất: O2, S, SO2, H2S, H2SO4. Có bao nhiêu chất vừa có tính oxi hóa, vừa có tính khử?
A. 4. B. 2. C. 1. D. 3.
Câu 13: Đổ dung dịch chứa 1 gam HCl vào dung dịch chứa 1 gam NaOH. Nhúng quỳ tím vào dung dịch thu được thì quỳ tím chuyển sang màu nào?
A. Màu xanh B. Màu đỏ C. Màu tím D. Màu vàng
Câu 14: Cấu hình electron lớp ngoài cùng của lưu huỳnh là :
A. 3s23p4 B. 3s23p6 C. 3s23p3 D. 2s22p4
Câu 15: Tầng ozon có khả năng ngăn tia cực tím từ vũ trụ thâm nhập vào trái đất vì
A. Tầng ozon có khả năng phản xạ ánh sáng tím.
B. Tầng ozon đã hấp thụ tia cực tím cho cân bằng chuyển hóa ozon và oxi.
C. Tầng ozon rất dày, ngăn không cho tia cực tím đi qua.
D. Tầng ozon chứa khí CFC có tác dụng hấp thụ tia cực tím.
Câu 16: Cho hệ cân bằng sau được thực hiện trong bình kín : 2SO2(k) + O2(k)  2SO3 (k),
2SO3 (k),  H < 0
H < 0
Yếu tố nào sau đây giúp làm tăng hiệu suất tổng hợp SO3?
A. Giảm nhiệt độ, tăng áp suất B. Tăng nhiệt độ, giảm áp suất
C. Tăng nhiệt độ, tăng áp suất D. Giảm nhiệt độ, giảm áp suất
Câu 17: Cho các phương trình hóa học sau:
(1) F2 + H2O → HF + HFO (2) 2KBr + I2 → 2KI + Br2
(3) NaF + AgNO3 → AgF + NaNO3 (4) Cl2+ 2FeCl2→ 2FeCl3
Số phương trình hóa học không đúng là: A. 4 B. 3 C. 2 D. 1
Câu 18: Cho 2,8 g 1 kim loại R bằng H2SO4 đặc nóng thu được 1,68 lít khí SO2 (đktc) sản phẩm khử duy nhất. R là:A. Cu B. Al C. Fe D. Ag
Câu 19: Kim loại Cu không phản ứng được với chất nào sau đây:
A. H2SO4 loãng B. H2SO4 đặc C. O2 D. Cl2
Câu 20: Trong các chất sau, chất nào chỉ có tính khử?
A. S. B. SO2. C. H2S. D. H2SO4.
ĐỀ THAM KHẢO SỐ 3
Câu 1: Dẫn khí X đến dư qua dung dịch brom, thấy dung dịch brom bị mất màu. Khí X có thể là
A. SO3. B. CO2. C. SO2. D. Cl2.
Câu 2: Hấp thụ hoàn toàn 2,24 lit khí SO2 (đktc) vào dung dịch chứa 0,2 mol NaOH. Sau phản ứng thu được dung dịch chứa muối
A. NaHSO3. B. Na2S. C. Na2SO3. D. Na2SO4.
Câu 3: Nhiệt phân hoàn toàn 30,02 gam KMnO4 với hiệu suất là 75%, thể tích O2 (đktc) thu được là
A. 2,128 lít. B. 2,837 lít. C. 1,596 lít. D. 2,576 lít.
Câu 4: Cho m gam Cu tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng (dư) thu được 6,72 lít khí SO2 (ở đktc, sản phẩm khử duy nhất). Giá trị của m là
A. 9,6. B. 4,8. C. 1,92. D. 19,2.
Câu 5: Một mẫu khí thải công nghiệp có nhiễm các khí H2S, CO, CO2. Để nhận biết sự có mặt của H2S trong mẫu khí thải đó, ta dùng dung dịch
A. NaOH. B. Pb(NO3)2. C. Ca(OH)2. D. NaNO3.
Câu 6: Cho 20 gam hỗn hợp KHCO3 và CaCO3 vào dung dịch HCl dư, sau khi phản ứng hoàn toàn thu được V lit khí (đktc). Giá trị của V là
A. 4,48. B. 1,12. C. 2,24. D. 3,36.
Câu 7: Hòa tan hoàn toàn 14,40 gam kim loại M (hóa trị II) trong dung dịch HCl loãng (dư) thu được 13,44 lít khí H2 (đktc). Kim loại M làA. Mg. B. Ca. C. Ba. D. F.
Câu 8: Hòa tan hoàn toàn 6,1 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 2,24 lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 31,80. B. 31,40. C. 15,7. D. 8,98.
Câu 9: Dùng bông tẩm dung dịch axit sunfuric rồi viết lên tờ giấy trắng, sau đó hơ nóng trên ngọn lửa đèn cồn thì thấy nét chữ xuất hiện màu đen do dung dịch axit sunfuric đặc có tính háo nước. Axit sunfuric có công thức phân tử làA. HCl. B. H2S. C. Na2SO4. D. H2SO4.
Câu 10: Kim loại nào sau đây phản ứng được với dung dịch H2SO4 đặc nguội?
A. Au. B. Cu. C. Fe. D. Al.
Câu 11: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là:
A. Ag,Mg,Pb,Fe. B. Cu,Zn,Au,Pt C. Cu,Zn,Ca,Al D. Mg,Na,Fe,Al
Câu 12: Phản ứng nào không xảy ra được giữa các cặp chất sau?
A. Ba(NO3)2 và Na2SO4B. AgNO3 và NaCl C. Cu(NO3)2 và NaOH D. KNO3 và NaCl
Câu 13: Phản ứng tổng hợp NH3 theo phương trình hóa học N2 + 3 H2 2NH3 ;
2NH3 ;  .
.
Để cân bằng chuyển dời theo chiều thuận cần:
A. giảm nhiệt độ B. A và C C. tăng nhiệt độ D. tăng áp suất
Câu 14: Cho 14.7g axit sunfuric loãng tác dụng với Fe dư. Tính thể tích khí bay ra vào cho biết tên chất khí.
A. 1,68 lít H2 B. 3,36 lít H2 C. 3,36 lít SO2 D. 1,68 lít SO2
Câu 15: Cho 15,8 gam KMnO4 tác dụng hoàn toàn với HCl đặc, dư. Thể tích khí thu được ở (đktc) là:
A. 3,36 lít B. 1,12 lít C. 5,6 lít D. 2,24 lít
Câu 16: Tính oxi hoá của các halogen được sắp xếp như sau:
A. Cl2 > F2 > Br2 > I2 B. I2> Br2 >Cl2 > F2 C. F2 >Cl2 > Br2 > I2 D. Br2 > F2> I2 >Cl2
Câu 17: Đặc điểm chung của các nguyên tố halogen là:
A. vừa có tính oxi hóa, vừa có tính khử B. có tính oxi hóa mạnh
C. Ở điều kiện thường là chất khí D. tác dụng mạnh với nước
Câu 18: Hơi thủy ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là:A. Cát B. Muối ăn C. Lưu huỳnh D. Vôi sống
Câu 19: Cho 16 gam hỗn hợp bột Fe và Mg tác dụng với dung dịch HCl dư thấy có 1 gam khí H2 bay ra. Khối luợng muối tạo ra trong dung dịch là:
A. 51,5 gam. B. 33,75 gam. C. 87 gam. D. 52,5 gam.
Câu 20: Cho 18,2 gam hỗn hợp 2 kim loại Cu và Al vào dung dịch HCl thu được 6,72 lít khí H2 (đktc), dung dịch X và chất rắn không tan B. Cho B phản ứng với H2SO4 đặc thu 4,48 lít khí SO2 (đktc). Khối lượng mỗi kim loại trong hỗn hợp ban đầu lần lượt là:
A. 12,8 gam Cu và 11,8 gam Al B. 6,4 gam Cu và 5,4 gam Al
C. 6,4 gam Cu và 11,8 gam Al D. 12,8 gam Cu và 5,4 gam Al
B. BÀI TẬP TỰ LUẬN
Câu 1: Thực hiện các dãy chuyển hóa sau, ghi rõ điều kiện phản ứng (nếu có):
a) NaCl → Cl2 → HCl → NaCl → HCl → Cl2 → Br2 → I2 → AlI3
b)FeS2  SO2
SO2  S
S  SO2
SO2  SO3
SO3  H2SO4
H2SO4  FeSO4
FeSO4  FeCl3
FeCl3  Fe(NO3)3
Fe(NO3)3
c) KClO3→ O2→ SO2 → H2SO4 →CuSO4 →Fe2(SO4)3 → BaSO4
Câu 2: Nêu hiện tượng và viết ptpư khi:
a) Cho dd Na2S vào dd Pb(NO3)2. b) Để lâu lọ chứa dd H2S mở nắp lâu ngày.
c) Sục khí SO2 vào dd nước Br2. d) Cho H2SO4 đặc vào cốc chứa đường saccarozơ.
Câu 3: Viết phương trình hóa học chứng minh
a) Cl2 vừa có tính khử vừa có tính oxi hóa.
c) Tính oxi hóa của Br2 > I2.
d) Tính oxi hóa của O3 mạnh hơn O2.
Khí SO2 làm mất màu dd nước Br2.
Câu 4: Hòa tan 8,3 gam hỗn hợp gồm Al và Fe trong dung dịch HCl dư thu được 5,6 lít khí H2 (đkc) và dung dịch A.
a)Tính % khối lượng mỗi kim loại có trong hỗn hợp ban đầu ?
b)Tính thể tích dd HCl 2M ban đầu, biết người ta dùng dư 10% so với lí thuyết.
c)Tính nồng độ mol/lit của các chất có trong dung dịch A?
Câu 5: Hỗn hợp X gồm 11,2 gam Fe và 7,2 gam FeO. Cho toàn bộ hỗn hợp X tác dụng dung dịch H2SO4 loãng dư thu được dung dịch Y và V1 lít khí (đktc). Cô cạn dung dịch Y thu được m gam muối khan.
a) Tính m và V1.
b) Nếu cho toàn bộ hỗn hợp X ở trên tác dụng với dung dịch H2SO4 đặc, nóng dư thu được V2 lít khí SO2 (đktc, sản phẩm khử duy nhất). Tính V2.
Câu 6: Đun nóng hỗn hợp gồm 6,72 gam Fe và 3,2 gam S trong điều kiện không có không khí đến khi phản ứng hoàn toàn thu được chất X. Cho X tác dụng với dung dịch H2SO4 đặc nóng dư thu được V lít khí SO2 (đktc, sản phẩm khử duy nhất).
a) X chứa chất gì? Khối lượng bằng bao nhiều?
b) Tính V?
Câu 7: Cho m gam hỗn hợp X gồm Fe và Cu. Chia hỗn hợp X thành 2 phần bằng nhau.
Phần 1: cho tác dụng với dung dịch H2SO4 loãng, dư thu được 1,12 lít khí (đktc)
Phần 2: cho tác dụng vừa đủ với V lít dung dịch H2SO4 đặc, nguội (98% ,D= 1,84g/ml) thu được 4,1216 lít khí (đktc)
a, Tính m và phần trăm theo khối lượng mỗi kim loại trong X
b, Tính V
Câu 8: Cho cân bằng hoá học: N2(k) + 3H2(k)  2NH3(k) ∆H <0.
2NH3(k) ∆H <0.
Cân bằng trên chuyển dịch theo chiều nào khi:
Thêm vào một lượng H2.
Tăng áp suất của hệ.
Tăng nhiệt độ của hệ.
Câu 9: Cân bằng hóa học sau được thiết lập trong bình kín:
2SO2(k) + O2(k)  2SO3(k) ∆H <0
2SO3(k) ∆H <0
Cân bằng phản ứng sẽ chuyển dịch về phía nào khi:
a. Thêm một lượng oxi vào hệ b. Giảm nhiệt độ của hệ c. Tăng áp suất của hệ.
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
II–Tự luận (5,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
a. Fe + Cl2  ……………………………………………………………………………………………
……………………………………………………………………………………………
b. Ba(NO3)2 + MgSO4  …………………………………………………………………………………….
…………………………………………………………………………………….
c. HCl + Mg(OH)2  ……………………………………………………………………………………….
……………………………………………………………………………………….
d. P + H2SO4 đặc, nóng  …………………………………………………………………………………
…………………………………………………………………………………
e. Al + H2SO4 đặc, nóng  SO2 + H2S + ..... ……………………………………………………
SO2 + H2S + ..... ……………………………………………………
(biết tỉ lệ mol SO2 và H2S là 1 : 3)
Bài 2. (2,5 điểm)
Hòa tan 22,8 gam hỗn hợp X gồm Mg và Fe vào dung dịch H2SO4 98% (đặc, nóng, dư). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và thu được dung dịch Y.
a. Tính thành phần % khối lượng mỗi kim loại trong X. (1,5 điểm)
b. Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 400 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO4 98% ban đầu. (0,5 điểm)
c. Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 2:1) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng. (0,5 điểm)
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
ĐỀ THAM KHẢO HÓA 11
A. PHẦN TRẮC NGHIỆM KHÁCH QUAN (7 điểm)
Câu 1: Etan có công thức phân tử là
A. C3H6. B. C3H8. C. C2H4. D. C2H6.
Câu 2: Chất nào sau đây là đồng phân của but – 2 – en?
A. But – 1 – en. B. But – 2 – in. C. But – 1 – in. D. Buta – 1,3 – đien.
Câu 3: Số liên kết đôi C=C trong phân tử isopren là
A. 2. B. 3. C. 4. D. 1.
Câu 4: Dãy đồng đẳng của benzen có công thức phân tử chung là
A. CnH2n + 2 với (n  1). B. CnH2n với (n
1). B. CnH2n với (n  2). C. CnH2n – 2 với (n
2). C. CnH2n – 2 với (n  3). D. CnH2n – 6 với (n
3). D. CnH2n – 6 với (n  6).
6).
Câu 5: Chất nào sau đây không làm mất màu dung dịch thuốc tím (KMnO4) ngay cả khi đun nóng?
A. Toluen B. Stiren C. Benzen D. Hexen
Câu 6: Ở điều kiện thường chất nào sau đây là chất lỏng?
A. Metan. B. Bezen. C. Etilen. D. Axetilen.
Câu 7: Tên thay thế của CH3OH là
A. etanol. B. metanol. C. propanol. D. ancol etylic.
Câu 8: Ancol etylic không tác dụng với chất nào sau đây?
A.Na. B. CuO (đun nóng). C. axit HBr (đun nóng). D. NaOH.
Câu 9: Glixerol có số nhóm hiđroxyl (-OH) trong phân tử là
A. 1. B. 2. C. 3 . D. 4.
Câu 10: Phenol không phản ứng với chất nào sau đây ?
A. Na. B. NaOH. C. NaHCO3. D. Br2.
Câu 11: Phenol rất độc, do đó khi sử dụng phenol phải hết sức cẩn thận. Công thức cấu tạo của phenol là
A. C6H5OH. B. C6H5CH2OH. C. C6H5CH3. D. C2H5OH.
Câu 12: Dung dịch nước của fomanđehit (fomon) được dùng làm chất tẩy uế, ngâm mẫu động vật làm tiêu bản, …. Công thức cấu tạo của fomanđehit là
A. HCHO. B. CH3CHO. C. C2H5CHO. D. (CH3)2CHCHO.
Câu 13:Chất nào sau đây tham gia phản ứng tráng bạc?
A. CH3OH. B. CH3CHO. C. C6H5OH. D. CH3COOH.
Câu 14: Anđehit axetic được điều chế trực tiếp từ chất nào sau đây?
A. metanol. B. propanol. C. etanol. D. phenol .
Câu 15: Công thức cấu tạo thu gọn của axit axetic là
A. CH3OH. B. CH3CHO. C. C6H5OH. D. CH3COOH.
Câu 16: Chất nào sau đây có nhiệt độ sôi cao nhất?
A. Axit fomic. B.Axit axetic . C. Etanal. D. Etan.
Câu 17: Đốt cháy hoàn toàn 0,015 mol C3H8, thu được H2O và m gam CO2. Giá trị của m là
A. 1,98. B. 0,54. C. 0,66. D.0,18 .
Câu 18: Chất nào sau đây là sản phẩm chính khi hiđrat hóa but – 1 – en?
A.CH3CH2CH(OH)CH3. B. CH3CH2CH2CH2OH. C. CH3CH2CH2CH3. D. CH3CH2CH2CH2Cl.
Câu 19: Phát biểu nào sau đây đúng?
A. Các hiđrocacbon thơm có nhiệt độ sôi tăng theo chiều tăng của phân tử khối.
B. Công thức phân tử của benzen là C8H8.
C. Toluen không làm mất màu dung dịch KMnO4 khi đun nóng.
D. Công thức phân tử chung dãy đồng đẳng của benzen là CnH2n-2 (n ).
).
Câu 20: Toluen tác dụng với Br2 ( t0) theo tỉ lệ mol 1:1, thu được chất hữu cơ X. Công thức cấu tạo thu gọn của X là
A.C6H5CH2Br . B. C6H5Br. C. CH3C6H4Br. D.C6H5CHBrCH2Br .
Câu 21: Cho a mol ancol CH3OH tác dụng hoàn toàn với kim loại Na dư, thu được 4,48 lít khí H2 (ở đktc). Giá trị của a là
A. 0,2. B. 0,6 . C. 0,4. D. 0,1.
Câu 22: Đun etanol với H2SO4 đặc ở 1800C, thu được chất nào sau đây?
A. Propen. B. Eten. C. Propan. D. Etan.
Câu 23: Chọn phát biểu sai:
A. Phenol có tính axit nhưng yếu hơn axit cacbonic.
B. Giữa nhóm -OH và vòng benzen trong phân tử phenol không có ảnh hưởng qua lại với nhau.
C. Phenol tác dụng được với natrihidroxit tạo thành muối và nước.
D. Dung dịch phenol không làm đổi màu quỳ tím vì tính axit của phenol rất yếu.
Câu 24: Cả phenol và ancol etylic đều phản ứng được với
A. Na B. NaOH C. Br2 D. NaHCO3.
Câu 25: Cho m gam CH3CHO tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 3,24 gam Ag. Giá trị của m là
A. 0,88. B. 0,44. C.1,32 . D. 0,66.
Câu 26: Hiđro hóa hoàn toàn metanal (xúc tác Ni,to), thu được sản phẩm là
A. axit axetic. B. ancol etylic. C. metanol. D. etilen.
Câu 27: Nhỏ dung dịch chất nào sau đây vào đá vôi, thấy có khí CO2 thoát ra?
A. Phenol. B. Axit axetic. C. Metanol. D. Propanal.
Câu 28: Để phân biệt ba dung dịch: dung dịch etanol, dung dịch glixerol và dung dịch phenol, ta lần lượt dùng các hóa chất nào sau đây ?
A. Na, nước Br2. B. NaOH, Na C. nước Br2, Cu(OH)2 D. nước Br2, Na.
B.PHẦN TỰ LUẬN (3 điểm)
Câu 29 (1 điểm). Hoàn thành các phương trình hóa học sau
a) C6H5OH + NaOH  b) CH3COOH + Na2CO3
b) CH3COOH + Na2CO3 
c) C2H5OH + O2(dư)  d) CH2=CH2 + HCl
d) CH2=CH2 + HCl 
Câu 30 (1 điểm). X là ancol no, đơn chức mạch hở. Cho 3,6 gam X tác dụng với Na dư thu được 0,672 lít H2 (ở đktc). Viết công thức cấu tạo và gọi tên của X.
Câu 31 (0,5 điểm). Chia m gam hỗn hợp A gồm axit axetic và ancol etylic thành 2 phần bằng nhau.
Phần 1: tác dụng hết với Na dư thu được 2,24 lit khí H2 (đktc).
Phần 2: trung hòa vừa đủ với 150 ml dd NaOH 1M.
Tính m?
Câu 32 (0,5 điểm). Hợp chất hữu cơ X (phân tử có vòng benzen) có CTPT là C7H8O2 , tác dụng được với Na và với NaOH. Biết:
- Khi cho a mol X tác dụng với Na dư thì thu được a mol khí H2.
- a mol X tác dụng vừa đủ với a mol dung dịch NaOH.
Xác định công thức cấu tạo thu gọn của X?
(Cho Ag= 108, C=12, H=1,O=16)
................HẾT.................
ĐỀ SỐ 2
(Biết C = 12; H = 1; O = 16; N = 14; Ag = 108; Na = 23; K = 39; Br = 80)
I. PHẦN TRÁC NGHIỆM (7 điểm)
Câu 1. Trong số các chất sau chất nào tác dụng được với dung dịch AgNO3 trong NH3 tạo kết tủa vàng?
A.  B. CH3-CH=CH2 C. CH3-CH2-CH3 D. CH3-CH3
B. CH3-CH=CH2 C. CH3-CH2-CH3 D. CH3-CH3
Câu 2. Dãy đồng đẳng anken có công thức phân tử chung là
A. CnH2n-2(n 2) B. CnH2n+2(n
2) B. CnH2n+2(n 1) C. CnH2n+1 (n
1) C. CnH2n+1 (n 1) D. CnH2n(n
1) D. CnH2n(n 2)
2)
Câu 3. Hiện nay nhiều nơi ở nông thôn đang sử dụng hầm biogas để xử lí chất thải trong chăn nuôi gia súc, cung cấp nhiên liệu cho việc đun nấu. Thành phần chính trong khí biogas là khí metan. Khí metan có công thức phân tử là
A. C3H6 B. C2H4 C. CH4 D. C2H2
Câu 4. Theo danh pháp IUPAC, hợp chất CH3-CH2-COOH có tên gọi là
A. Axit pentannoic B. Axit butanoic C. Axit propanoic D. Axit metanoic
Câu 5. Dẫn V lít (ở đktc) hỗn hợp X gồm axetilen và hiđro đi qua ống sứ đựng bột niken nung nóng, thu được khí Y. Dẫn Y vào lượng dư AgNO3 trong dung dịch NH3thu được 12 gam kết tủA. Khí đi ra khỏi dung dịch phản ứng vừa đủ với 16 gam brom và còn lại khí Z. Đốt cháy hoàn toàn khí Z thu được 2,24 lít khí CO2(ở đktc) và 4,5 gam nước. Giá trị của V bằng?
A. 11,2 lít B. 5,60 lít C. 8,96 lít D. 13,44 lít
Câu 6. Ancol là những hợp chất hữu cơ trong phân tử có nhóm…(1)….liên kết trực tiếp với….(2)…….. Điền cụm từ thích hợp vào (1) và (2).
A. 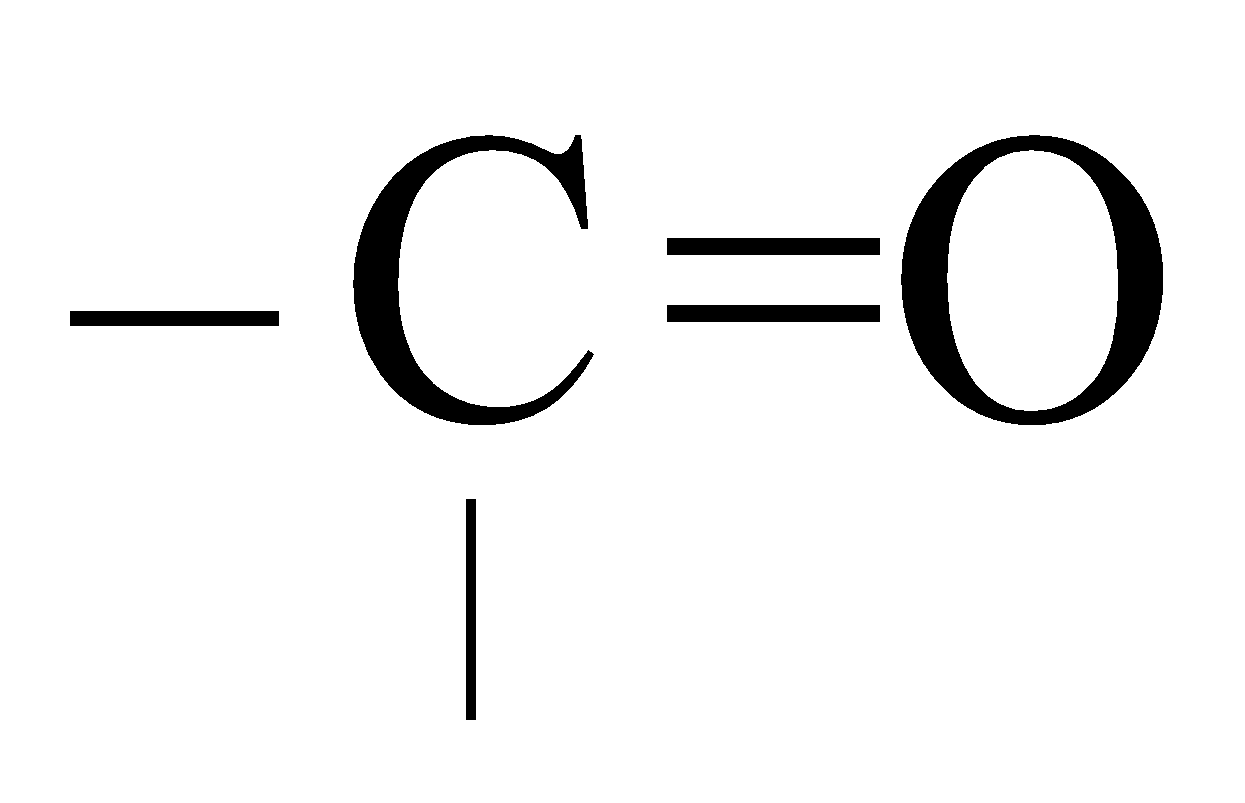 , nguyên tử cacbon hoặc nguyên tử hiđro
, nguyên tử cacbon hoặc nguyên tử hiđro
B. –COOH (cacboxyl), nguyên tử cacbon hoặc nguyên tử hiđro
C. –OH (hiđroxyl), nguyên tử cacbon no
D. –CH=O, nguyên tử cacbon hoặc nguyên tử hiđro
Câu 7. Hóa hơi 8,64 gam hỗn hợp gồm một axit no, đơn chức, mạch hở X và một axit no, đa chức Y (có mạch cacbon hở, không phân nhánh) thu được một thể tích hơi bằng thể tích của 2,8 gam N2 (đo trong cùng điều kiện nhiệt độ, áp suất). Đốt cháy hoàn toàn 8,64 gam hỗn hợp hai axit trên thu được 11,44 gam CO2. Tính phần trăm khối lượng của X trong hỗn hợp ban đầu.
A. 72,22 % B. 35,25 % C. 65,15 % D. 27,78 %
Câu 8. Khi cho CH3-CH2-CH3 tác dụng với Cl2 (ánh sáng, tỉ lệ mol 1:1). Số sản phẩm monoclo tối đa thu được là
A. 1 B. 2 C. 4 D. 3
Câu 9. Nhóm chức của anđehit là
A. -NH2 B. -COOH C. -CHO D. -OH
Câu 10. Cho 4,6 gam glixerol tác dụng hết với V ml dung dịch HCl 1M. Giá trị của V bằng?
A. 250ml B. 300 ml C. 150ml D. 200ml
Câu 11. Giấm là một chất lỏng có vị chua, được hình thành nhờ sợ lên men của ancol etylic. Thành phần chính của giấm là axit axetic có nồng độ từ 2% đến 5%. Axit axetic có công thức?
A. C2H5OH B. CH3COOH C. CH3OH D. HCHO
Câu 12. Trước kia thuốc trừ sâu 666 được sử dụng rộng rãi trong nền nông nghiệp nhưng do chất này có độc tính cao và phân hủy chậm nên đã bị cấm sử dụng tại 169 quốc gia tham gia công ước Stockholm. Chất được sử dụng làm thuốc trừ sâu 666 có công thức là
A. C2H2 B. C6H6Cl6 C. C4H6 D. C3H8
Câu 13. Cho phản ứng: 
Xác định vai trò của CH3CHO trong phản ứng trên
A. Chất khử B. Axit C. Chất oxi hóa D. Bazơ
Câu 14. Để trung hòa hoàn toàn 6 gam axit axetic cần dùng V lít dung dịch NaOH 1M. Giá trị của V?
A. 0,05 lít B. 0,1 lít C. 0,2 lít D. 0,15 lít
Câu 15. Sản phẩm sinh ra trong thí nghiệm sau là gì?
A. CH3COOH B. (CH3CH2)2O C. CH3−CO−CH3 D. CH3CHO
Câu 16. Tính chất hóa học đặc trưng của ankan?
A. Phản ứng cộng B. Phản ứng trùng hợp
C. Phản ứng thế D. Phản ứng tách
Câu 17. Khí axetilen là nhiên liệu trong đèn xì oxi – axetilen đề hàn cắt kim loại vì phản ứng cháy của khí axetilen trong oxi tỏa ra lượng nhiệt rất lớn. Thể tích khí oxi (ở điều kiện tiêu chuẩn) cần để đốt cháy hết 1 mol khí axetilen là
A. 56 lít B. 112 lít C. 70 lít D. 65 lít
Câu 18. Dãy đồng đẳng của benzen (C6H6)có công thức phân tử chung là
A. CnH2n(n  2) B. CnH2n+2 (n
2) B. CnH2n+2 (n  1)
1)
C. CnH2n-6 (n  6) D. CnH2n-2 (n
6) D. CnH2n-2 (n  2)
2)
Câu 19. Phenol có công thức là
A. CH3OH B. CH3COOH C. C6H5OH D. C2H4
Câu 20. Ankađien là những hiđrocacbon mạch hở trong phân tử
A. Có 1 liên kết đôi C=C B. Chỉ có liên kết đơn
C. Có 2 liên kết đôi C=C D. Có 1 liên kết C C
C
Câu 21: Làm thí nghiệm như hình vẽ

Hiện tượng xảy ra trong ống nghiệm khi cho dư glixerol (C3H5(OH)3), lắc đều là gì?
A. Kết tủa tan, tạo dung dịch có màu xanh lam.
B. Không có hiện tượng gì.
C. Kết tủa vẫn còn, dung dich có màu trong suốt.
D. Kết tủa tan, dung dịch có màu nâu đỏ
Câu 22: Chất có công thức CH CH có tên gọi là
CH có tên gọi là
A. Etan. B. Metan. C. Etilen. D. Axetilen.
Câu 23: Đốt cháy hoàn toàn một ancol đơn chức (X) thu được 4,48 lít khí CO2 (đktc) và 4,5 gam H2O. Công thức của ancol (X) là
A. C3H7OH. B. C4H9OH. C. C2H5OH. D. CH3OH.
Câu 24: Thuốc thử để phân biệt hai khí but -2-in, but-1-in là
A. Dung dịch AgNO3 /NH3. B. Dung dịch KMnO4.
C. Dung dịch HCl. D. Dung dịch Br2.
Câu 25: Cho 0,94 gam phenol( C6H5OH) tác dụng vừa đủ với Vml dung dịch NaOH 1M. Giá trị của V là
A. 40ml B. 20ml C. 30ml D. 10ml
Câu 26: Dẫn 4,48 lít (đktc) hỗn hợp X gồm hai anken đồng đẳng kế tiếp qua bình đựng dung dịch brom dư thấy khối lượng bình sau phản ứng tăng thêm 7 gam. Biết các phản ứng xảy ra hoàn toàn. Công thức phân tử của 2 anken là
A. C4H8 và C5H10. B. C3H6 và C4H8.
C. C2H4 và C3H6. D. C5H10 và C6H12.
Câu 27: Metan là ankan có trong thành phần chính của khí thiên nhiên, khí biogas. Metan có công thức là
A. C2H6 B. C2H4 C. C2H2. D. CH4
Câu 28: Cho đốt cháy hết m gam hỗn hợp X các ancol trong dãy đồng đẳng thì thu được 11,2 lít khí CO2 ở đktc và 12,6 gam nước. Vậy m gam hỗn hợp X tác dụng với Na dư thì lượng khí H2 thoát ra là V lít(đktc). Giá trị lớn nhất của V là
A. 6,72. B. 2,24. C. 4,48. D. 3,36.
II. PHẦN TỤ LUẬN (3 ĐIỂM)
Câu 1: (1 điểm)
a. Gọi tên các hợp chất sau: CH3OH; CH3-CHO
b. Viết công thức cấu tạo thu gọn các hợp chất sau: axit fomic, butan-2-ol
Câu 2: (1 điểm) Bằng phương pháp hóa học hãy nhận biết các ống nghiệp đựng các dung dịch hóa chất sau: Axit axetic (CH3COOH), ancol etylic (C2H5OH), phenol (C6H5OH).
Câu 3: (0,5 điểm) Cho 9 gam một axit cacboxylic no, đơn chức, mạch hở tác dụng với natri dư thì thu được 1,68 lít khí H2 (đktc). Xác định công thức của axit cacboxylic?
Câu 4: (0,5 điểm) Cho sơ đồ phản ứng sau:
Metan X
X Y
Y Z
Z T
T
Xác định công thức các chất X, Y, Z, T và viết các phương trình (1), (2), (3), (4). Biết T là chất no đơn chức và có 4 nguyên tử cacbon trong phân tử
(Học sinh không được sử dụng tài liệu)
------ HẾT ------
ĐỀ SỐ 3
I. PHẦN TRẮC NGHIỆM (7 ĐIỂM)
Cho nguyên tử khối của các nguyên tố (đvC): H=1; He=4; C=12; N=14; O=16; Na=23; Mg=24; Al=27; P=31; S=32; Cl=35,5; K=39; Ca=40; Fe=56; Cu=64; Br=80; Ag=108; Ba=137;
Câu 1: Đun nóng butan-2-ol trong điều kiện H2SO4 đặc, 1700C tạo ra tối đa bao nhiêu anken là đồng phân của nhau (tính cả đồng phân hình học cis, trans)?
A. 3 B. 2 C. 1 D. 4
Câu 2: Metanol là một độc tố ngây chết người hàng đầu trong các vụ ngộ độc rượu. Công thức phân tử của metanol là
A. HCHO. B. C6H5OH. C. CH3OH. D. C6H5CH2OH.
Câu 3: Tên thay thế của ancol có công thức cấu tạo thu gọn CH3CH2CH2OH là
A. propan-2-ol. B. pentan-1-ol. C. pentan-2-ol. D. propan-1-ol.
Câu 4: Đun nóng một ancol đơn chức X thu được 14,8 gam ete và 3,6 gam H2O. Công thức ancol X là
A. C3H5OH. B. C3H7OH C. C4H7OH. D. C2H5OH.
Câu 5: Thủy phân chất X trong nước thu được khí metan. Vậy X là
A. Al4C3. B. CaO. C. Na. D. CaC2.
Câu 6: Cho 0,01 mol phenol (C6H5OH) tác dụng vừa đủ với dung dịch Br2 loãng thu được m gam kết tủa trắng là 2,4,6 -tribromphenol. Giá trị của m là
A. 3,31. B. 6,62 C. 9,93. D. 4,43.
Câu 7: Hỗn hợp E gồm ancol etylic và hai hiđrocacbon mạch hở thuộc cùng dãy đồng đẳng. Hóa hơi m gam E thu được thể tích bằng với thể tích của 0,96 gam khí O2 ở cùng điều kiện. Mặt khác đốt cháy m gam E cần vừa đủ 0,3 mol O2, sau phản ứng thu được 0,195 mol CO2. Khối lượng C2H5OH trong hỗn hợp hợp E là
A. 0,92 gam. B. 0,69 gam. C. 0,46 gam. D. 0,23 gam.
Câu 8: Chất nào mất màu dung dịch Br2 là
A. Benzen B. Hexan C. Etilen D. Metan
Câu 9: Công thức tổng quát của ancol no, đơn chức, mạch hở là
A. CnH2n-1OH. B. CnH2n+2-OH. C. CnH2n-2-OH. D. CnH2n+1-OH.
Câu 10: Cho 224 ml khí etilen ở đktc phản ứng vừa đủ với V ml dung dịch Br2 0,5M. Giá trị của V là
A. 10 B. 20. C. 40 D. 80
Câu 11: Cho 12 gam ancol X no, đơn chức, mạch hở phản ứng với Na (dư) thu được 2,24 lit khí H2 (đktc). Công thức phân tử của X là:
A. C3H7OH. B. C2H5OH. C. CH3OH. D. C4H9OH
Câu 12: Đun nóng 11,6 gam C4H10 một thời gian, thu được hỗn hợp X gồm chất: H2, CH4, C2H6, C4H8, C3H6, C2H4, C4H10. Đốt cháy hoàn toàn X rồi cho sảng phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư, thấy khối lượng bình tăng lên m gam. Giá trị của m là?
A. 80,0. B. 35,2. C. 18.0. D. 53,2.
Câu 13: Đốt cháy hoàn toàn một hiđrocacbon X thu được 6,72 lít CO2 (đktc) và 7,2 gam H2O. CTPT của X là:
A. C2H6 B. C3H8 C. C4H10 D. C3H6
Câu 14: Đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm các ankan thu được 0,35 mol CO2 và m gam H2O. Giá trị của m là
A. 8,1 B. 9,0 C. 4,5 D. 7,2
Câu 15: Dãy đồng đẳng của axetilen hay ankin có công thức chung là
A. CnH2n+2 (n ≥ 2) B. CnH2n (n ≥ 2)
C. CnH2n-2 (n ≥ 2) D. CnH2n-6 (n ≥ 6)
Câu 16: Số đồng phân cấu tạo ancol ứng với công thức phân tử C4H10O là
A. 5. B. 3. C. 4. D. 2.
Câu 17: Ancol X là một ancol khi đốt cháy m gam thu được a mol CO2, còn nếu cho 2 m gam X tác dụng với Na dư thấy cũng thu được a mol khí H2. Vậy X là
A. Ancol etylic. B. Glixerol.
C. Ancol benzylic. D. Propan – 1,2 – điol.
Câu 18: Chất không tham gia phản ứng cộng với H2( Ni, t0) là
A. CH CH B. CH3-CH3
CH B. CH3-CH3
C. CH2=CH2 D. CH2=CH-CH=CH2
Câu 19: Cho 1 mẩu Na nhỏ bằng hạt đậu vào ống nghiệm chứa 2 - 3 ml chất lỏng X, thấy giải phóng khí Y. Đốt cháy Y trong không khí, thấy Y cháy với ngọn lửa màu xanh nhạt. Chất X là
A. benzen. B. Đietyl ete. C. Hexan. D. Etanol.
Câu 20: Nhỏ dung dịch Br2 loãng vào dung dịch chứa chất X nhận thấy nước brom mất màu, đồng thời có kết tủa trắng xuất hiện. Vậy X là
A. C2H5OH B. C6H5OH
C. C6H5-CH=CH2 D. CH3COOH
Câu 21: Phenol (C6H5OH) không phản ứng với chất nào sau đây?
A. Na. B. NaOH.
C. Dung dịch HCl. D. Dung dịch Br2.
Câu 22: Xăng sinh học E5 đang được khuyến khích người tiêu dùng sử dụng, là loại xăng có chứa 5% về thể tích etanol. Etanol là tên gọi của chất nào?
A. CH3OH. B. CH3CHO. C. C3H8O3. D. C2H5OH.
Câu 23: Đun nóng ancol etylic với H2SO4 đặc ở 170°C, thu được một hiđrocacbon có công thức là
A. C2H2. B. C2H6. C. C2H4. D. CH4.
Câu 24: Chất có hai liên kết đôi trong phân tử là?
A. CH2=CH-CH=CH2 B. CH2=CH-C CH
CH
C. CH2=CH2 D. CH3-CH2- C CH
CH
Câu 25: Ankan X có tỷ khối hơi so với H2 là 29. Vậy công thức của X là
A. C4H10 B. C4H8 C. C2H6 D. C3H8
Câu 26: Công thức CH2=CH2 có tên gọi là
A. Propilen. B. Etilen. C. Etan. D. Axetilen.
Câu 27: Khi cho 4,6 gam ancol etylic tác dụng hết với Na dư, thu được V lít khí H2 (đktc). Giá trị của V là
A. 4,48 lít. B. 1,12 lít. C. 3,36 lít. D. 2,24 lít.
Câu 28: Dẫn khí X đi qua dung dịch AgNO3/NH3 nhận thấy có kết tủa vàng nhạt xuất hiện. Vậy X là
A. CH CH B. CH2=CH2 C. CH4 D. CH3-CH3
CH B. CH2=CH2 C. CH4 D. CH3-CH3
II. PHẦN TỤ LUẬN (3 ĐIỂM)
Câu 1: (1 điểm)
Hoàn thành các phương trình hóa học sau
a) C6H5OH + NaOH  b) CH3COOH + Na2CO3
b) CH3COOH + Na2CO3 
c) C2H5OH + O2(dư)  d) CH2=CH2 + HCl
d) CH2=CH2 + HCl 
Câu 2: (1 điểm) Bằng phương pháp hóa học hãy nhận biết các ống nghiệp đựng các dung dịch hóa chất sau: Axit axetic (CH3COOH), ancol etylic (C2H5OH), phenol (C6H5OH).
Câu 3: (0,5 điểm) : Đốt cháy hoàn toàn hỗn hợp các anken bằng oxi thu được 7,84 lít CO2(đktc) và m gam H2O. Giá trị của m là bao nhiêu?
Câu 4: (0,5 điểm) Đun nóng 11,6 gam C4H10 một thời gian, thu được hỗn hợp X gồm chất: H2, CH4, C2H6, C4H8, C3H6, C2H4, C4H10. Đốt cháy hoàn toàn X rồi cho sảng phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư, thấy khối lượng bình tăng lên m gam. Giá trị của m là?
(Học sinh không được sử dụng tài liệu)
------ HẾT ------
ĐỀ THAM KHẢO HÓA 12
ĐỀ 1
PHẦN TRẮC NGHIỆM: 7,0 điểm
Câu 1: Để điều chế kim loại kiềm, người ta dùng phương pháp nào sau đây?
A. Điện phân nóng chảy. B. Điện phân dung dịch. C. Thủy luyện. D. Nhiệt luyện.
Câu 2: Trong các hợp chất, K có số oxi hóa là
A. 0 và +1. B. +1. C. +1 và +2. D. +1 và -1.
Câu 3: Dung dịch thu được khi hòa tan kim loại Na vào nước là
A. NaOH. B. Na(OH)2. C. Na(OH)3. D. Na2O .
Câu 4: Kim loại nào sau đây là kim loại kiềm thổ?
A. Na. B. Fe. C. Ca. D. Cu.
Câu 5: Kim loại nào sau đây không tan trong nước ở bất kì nhiệt độ nào?
A. Ba. B. Ca. C. Mg. D. Be.
Câu 6: Công thức hóa học của thạch cao sống là
A. CaSO4.2H2O. B. CaSO4. C. CaSO4.3H2O. D. CaSO4.5H2O.
Câu 7: Nước cứng là nước có chứa nhiều ion
A. Mg2+, Ca2+. B. Ba2+, Mg2+. C. Cu2+, Mg2+. D. Na+, Ca2+.
Câu 8: Phèn chua được dùng trong ngành thuộc da, công nghiệp giấy, chất cầm màu trong công nghiệp nhuộm, chất làm trong nước. Công thức hóa học của phèn chua là
A. KAl(SO4)2.12H2O. B. NaAl(SO4)2.12H2O. C. NH4Al(SO4)2.12H2O. D. LiAl(SO4)2.12H2O.
Câu 9: Quặng nào sau đây dùng để sản xuất nhôm?
A. Boxit. B. Đolomit. C. Apatit. D. Pirit.
Câu 10: Tính chất vật lý nào dưới đây không phải của Fe?
A. Kim loại nặng, khó nóng chảy. B. Dẫn điện và dẫn nhiệt tốt.
C. Màu vàng nâu, dẻo, dễ rèn. D. Có tính nhiễm từ.
Câu 11: Fe phản ứng với dung dịch nào sau đây tạo khí H2?
A. H2SO4 loãng. B. HNO3. C. CuSO4. D. AgNO3.
Câu 12: Trong các loại quặng sắt, quặng có hàm lượng sắt cao nhất là
A. hematit nâu. B. manhetit. C. xiđerit. D. hematit đỏ.
Câu 13: Gang là hợp kim của
A. sắt với cacbon. B. sắt với photpho. C. sắt với lưu huỳnh. D. sắt với nhôm.
Câu 14: Các số oxi hóa thường gặp của Cr trong hợp chất là:
A. +1, +2, +6. B. +3, +4, +6. C. +2, +3, +6. D. +2, +4, +6.
Câu 15: Chất nào sau đây là oxit axit?
A. CrO3. B. FeO. C. Cr2O3. D. Fe2O3.
Câu 16: Tác nhân nào sau đây là nguyên nhân chính gây ra mưa axit?
A. NO2, SO2. B. SO3, CO2. C. CO2, NO2. D. N2, H2.
Câu 17: Khối lượng quặng boxit chứa 75% Al2O3 cần để sản xuất 1,5 tấn nhôm nguyên chất là (biết hiệu suất phản ứng điện phân đạt 90%)
A. 7,6 tấn. B. 8,4 tấn. C. 4,2 tấn. D. 3,8 tấn.
Câu 18: Hiện tượng xảy ra khi cho kim loại Na vào dung dịch CuSO4 là
A. sủi bọt khí không màu và có kết tủa màu xanh.
B. bề mặt kim loại có màu đỏ, dung dịch nhạt màu.
C. sủi bọt khí không màu và có kết tủa màu đỏ.
D. bề mặt kim loại có màu đỏ và có kết tủa màu xanh.
Câu 19: Nung hỗn hợp gồm MgCO3 và BaCO3 có cùng số mol đến khối lượng không đổi thu được khí X và chất rắn Y. Hòa tan Y vào nước dư, lọc bỏ kết tủa thu được dung dịch Z. Hấp thụ hoàn toàn khí X vào dung dịch T, sản phẩm sau phản ứng là
A. Ba(HCO3)2. B. BaCO3 và Ba(HCO3)2.
C. BaCO3 và Ba(OH)2. D. BaCO3.
Câu 20: Cho mẫu kim loại Mg vào dung dịch HNO3 loãng, sau phản ứng chỉ thu được dung dịch X. Muối có trong dung dịch X là
A. Mg(NO3)2. B. NH4NO3. C. Mg(NO3)2, NH4NO3. D. Mg(NO3)2, NH4NO2.
Câu 21: Dung dịch chất nào sau đây không thể hòa tan Al2O3?
A. NaOH. B. H2SO4. C. NH3. D. Ba(OH)2.
Câu 22: Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là
A. có kết tủa keo trắng và có khí thoát ra. B. có kết tủa keo trắng, sau đó kết tủa tan.
C. không có kết tủa, có khí thoát ra. D. chỉ có kết tủa keo trắng.
Câu 23: Hoà tan hoàn toàn m gam Fe trong dung dịch HNO3 loãng dư, sau khi phản ứng kết thúc thu được 0,448 lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A.11,2. B. 0,56. C. 5,60. D. 1,12.
Câu 24 :Hợp chất FeO thể hiện tính khử trong phản ứng với chất nào sau đây?
A. Dung dịch HNO3. B. Dung dịch HCl.
C. CO. D. Dung dịch H2SO4 loãng.
Câu 25 : Phương trình hóa học nào sau đây không đúng?
A. 2Cr + 3H2SO4 (loãng)  Cr2(SO4)3 + 3H2.
Cr2(SO4)3 + 3H2.
B. 2Cr + 3Cl2  2CrCl3.
2CrCl3.
C. Cr(OH)3 + 3HCl  CrCl3 + 3H2O.
CrCl3 + 3H2O.
D. Cr2O3 + 2NaOH (đặc)  2NaCrO2 + H2O.
2NaCrO2 + H2O.
Câu 26 : Cho các phát biểu sau:
(a) Lưu huỳnh, photpho, cacbon đều phản ứng với CrO3.
(b) Bột nhôm dễ phản ứng với khí Cl2.
(c) Phèn chua có công thức là KAl(SO4)2.12H2O.
(d) Cr2O3 là oxit lưỡng tính.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
Câu 27 : Hòa tan hoàn toàn hỗn hợp X gồm 0,02 mol Cr và 0,03 mol Fe trong trong dung dịch H2SO4 loãng dư thu được V lít H2 (đktc). Giá trị của V là
A. 1,120. B. 2,240. C. 0,448. D. 0,672.
Câu 28 : Cho các phát biểu sau:
(a) Trong tự nhiên, kim loại kiềm chỉ tồn tại dạng hợp chất.
(b) Al tác dụng mạnh với dung dịch HNO3 đặc nóng và H2SO4 đặc nóng.
(c) Có thể dùng dung dịch Na2CO3 để làm mềm nước cứng tạm thời.
(d) Hỗn hợp Cu và Fe2O3 với tỷ lệ mol 1 : 1 có thể tan hết trong nước dư.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
PHẦN TỰ LUẬN: 3,0 điểm
Câu 29 (1 điểm): Viết phương trình hóa học điều chế kim loại Ca từ CaCO3.
Câu 30 (1 điểm): Hòa tan hết 7,3 gam hỗn hợp bột Na, Al vào nước thu được 5,6 lít H2 (đktc).
a. Viết phương trình hóa học của các phản ứng xảy ra.
b. Tính phần trăm khối lượng của mỗi kim loại trong hỗn hợp.
Câu 31 (0,5 điểm): Hòa tan hoàn toàn 5,584 gam hỗn hợp Fe và Fe3O4 vào dung dịch HNO3 loãng, dư. Sau khi phản ứng hoàn toàn thu được 0,3136 lít khí NO (đktc, sản phẩm khử duy nhất của N+5) và dung dịch X chứa m gam muối. Tính giá trị m.
Câu 32 (0,5 điểm): Xác định các chất X, Y và viết phương trình hóa học của các phản ứng trong sơ đồ chuyển hóa sau:
NaOH  X
X  Y
Y NaOH
NaOH
------------------ Hết -----------------
ĐỀ 2
PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1. Kim loại nào sau đây được điều chế bằng phương pháp điện phân dung dịch?
A. Ba. B. Ag. C. Na. D. Ca.
Câu 2: Trong các hợp chất, Na có số oxi hóa là
A. 0 và +1. B. +1. C. +1 và +2. D. +1 và -1.
Câu 3: Natrihidrocacbonat có công thức phân tử là
A. NaOH. B. NaHCO3. C. NaCl. D. Na2SO4.
Câu 4: Trong bảng tuần hoàn, các kim loại kiềm thuộc nhóm
A. IA. B. IIA. C. IIIA. D. VA.
Câu 5: Sản phẩm thu được khi đốt Mg trong bình đựng khí clo là
A. MgCl2. B. MgCl. C. MgCl3. D. MgO.
Câu 6: Công thức hóa học của thạch cao nung là
A. CaSO4.2H2O. B. 2CaSO4.H2O. C. CaSO4.3H2O. D. CaSO4.
Câu 7: Cách làm mềm nước cứng tạm thời nào sau đây là đơn giản nhất?
A. Đun sôi B. Dùng dung dịch HCl loãng. C. Dùng dung dịch Na2CO3. D. Dùng dung dịch nước vôi trong.
Câu 8: Kim loại Al không có tính chất vật lí nào sau đây?
A. Dễ dát mỏng. B. Khối lượng riêng lớn C. Màu trắng bạc. D. Khá mềm.
Câu 9: Ứng dụng nào sau đây không đúng với nhôm và hợp kim của nhôm?
A. Hàn đường ray. B. Dụng cụ nhà bếp C. Chế tạo máy bay, ô tô, tên lửa. D. Dụng cụ y tế
Câu 10: Cấu hình electron nào sau đây là của ion Fe3+?
A. [Ar]3d6. B. [Ar]3d5. C. [Ar]3d4. D. [Ar]3d3.
Câu 11: Phương trình hóa học nào sau đây đúng?
A. Fe + H2SO4 → FeSO4 + H2. B. 2Fe + 6HCl → 2FeCl3 + 3H2.
C. Fe + 3AgNO3 → Fe(NO3)3 + 3Ag. D. Fe + Cl2 → FeCl2.
Câu 12: Công thức hóa học của sắt(II) clorua là
A. FeCl2. B. Fe(OH)3. C. FeSO4. D. Fe2O3.
Câu 13: Phát biểu nào sau đây không đúng?
A. Nguyên liệu sản xuất gang gồm quặng sắt, than cốc và chất chảy.
B. Chất khử trong quá trình sản xuất gang là cacbon monooxit.
C. Thép là hợp kim của sắt, chứa từ 0,01-2% khối lượng cacbon, ngoài ra còn có một số nguyên tố khác.
D. Để chuyển hóa gang thành thép có thể dùng bột nhôm để khử oxit sắt.
Câu 14: Trong các kim loại: Fe, Al, Na, Cr, kim loại cứng nhất là
A. Fe. B. Au. C. W. D. Cr.
Câu 15: Hợp chất nào sau đây có tính lưỡng tính?
A. CrCl3. B. NaOH. C. KOH D. Cr(OH)3.
Câu 16: Chất bột được dùng để khử tính độc của thuỷ ngân là
A. vôi sống. B. cát. C. lưu huỳnh. D. muối ăn.
Câu 17: Nguyên tắc chung để điều chế kim loại là
A. khử ion kim loại thành kim loại. B. oxi hóa kim loại thành ion kim loại.
C. oxi hóa ion kim loại thành kim loại. D. khử ion kim loại thành nguyên tử.
Câu 18: Cho 2,34 gam kim loại M thuộc nhóm IA phản ứng với H2O thu được 0,672 lit khí H2 (đktc) . Kim loại M là
A. K. B. Na. C. Li. D. Ag.
Câu 19: Dãy chất nào sau đây đều tác dụng với dung dịch Ca(OH)2?
A. Ca(HCO3)2, Na2CO3. B. MgO, HCl. C. NaHCO3, NaCl. D. Mg(OH)2, HCl.
Câu 20: Ứng dụng nào sau đây không phải của CaCO3?
A. Làm vôi quét tường. B. Làm vật liệu xây dựng.C. Sản xuất ximăng D. Sản xuật bột nhẹ để pha sơn.
Câu 21: Nhóm gồm tất cả các chất vừa tác dụng với dung dịch NaOH, vừa tác dụng với dung dịch HCl là
A. AlCl3, Al(OH)3. B. NaAlO2, Al2O3. C. Al2O3, Al(OH)3. D. Al2(SO4)3, NaAlO2.
Câu 22: Cho m gam Al phản ứng vừa đủ với 0,039 mol Cl2. Giá trị của m là
A. 1,053. B. 0,702. C. 0,175. D. 0,351.
Câu 23: Hòa tan 5,6 gam Fe trong lượng dư dung dịch HNO3 đặc nóng thấy thoát ra V lít khí NO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
A. 2,240. B. 4,480. C. 6,720. D. 8,960.
Câu 24: Thí nghiệm nào sau đây thu được muối sắt (III)?
A. Cho Fe(OH)2 vào dung dịch H2SO4 loãng. B. Cho Fe dư vào dung dịch Fe(NO3)3.
C. Cho Fe vào dung dịch HNO3 loãng, dư. D. Cho FeO vào dung dịch HCl.
Câu 25: Dung dịch X có màu đỏ cam. Nếu cho thêm vào một lượng KOH, màu đỏ của dung dịch dần dần chuyển sang màu vàng tươi. Nếu thêm vào đó một lượng H2SO4, màu của dung dịch dần dần trở lại đỏ cam. Dung dịch X là
A. K2Cr2O7. B. K2Cr2O4. C. KCr2O4. D. KMnO4.
Câu 26: Cho các phát biểu sau:
(1) Dẫn CO2 dư vào dung dịch Ca(OH)2, kết thúc phản ứng thu được kết tủa.
(2) Crom là kim loại có tính khử mạnh hơn sắt.
(3) Nhỏ đến dư dung dịch NH3 vào dung dịch AlCl3 thấy xuất hiện kết tủa.
(4) CaSO4.H2O được dùng để bó bột, nặng tượng và đúc khuôn.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 27: Thí nghiệm nào sau đây không thu được kết tủa?
A. Cho dung dịch KOH vào dung dịch FeCl3.
B. Cho dung dịch AgNO3 vào dung dịch Na3PO4.
C. Cho dung dịch NaOH dư vào dung dịch Al(NO3)3.
D. Cho dung dịch BaCl2 vào dung dịch K2SO4.
Câu 28: Cho các thí nghiệm sau (các phản ứng xảy ra hoàn toàn):
(a) Cho hỗn hợp Na và Al (tỉ lệ mol 3:1) vào nước dư;
(b) Cho hỗn hợp BaO và NH4Cl (tỉ lệ mol 1:2) vào nước dư;
(c) Cho Mg vào dung dịch HNO3 loãng dư, không có khí thoát ra;
(d) Sục khí CO2 dư vào dung dịch Ba(OH)2;
(e) Cho 1,2x mol Fe vào dung dịch chứa 4x mol HNO3 đun nóng (NO là sản phẩm khử duy nhất).
Số thí nghiệm thu được dung dịch chứa hai chất tan là
A. 4. B. 2. C. 5. D. 3.
PHẦN TỰ LUẬN:
Câu 29 (1,0 điểm): Viết phương trình hóa học các phản ứng trong sơ đồ chuyển hóa sau:
Fe  FeBr3
FeBr3  Fe(OH)3
Fe(OH)3 Fe2O3
Fe2O3  Fe3O4
Fe3O4
Câu 20 (1,0 điểm): Cho m gam hỗn hợp X gồm Al và Cr tác dụng với dung dịch HCl loãng, nóng dư thu được 10,08 lít H2 (đktc). Cũng lượng hỗn hợp X trên tác dụng với lượng dư dung dịch NaOH thu được 6,72 lít H2 (đktc).
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính m.
Câu 31 (0,5 điểm): Có 4 mẫu bột kim loại: K, Al, Fe, Ca. Chỉ dùng nước làm thuốc thử, trình bày cách nhận biết 4 kim loại trên.
Câu 32 (0,5 điểm): Cho một luồng khí CO đi qua ống sứ đựng 0,04 mol hỗn hợp A gồm FeO và Fe2O3 đốt nóng. Sau khi kết thúc thí nghiệm thu được hỗn hợp B gồm bốn chất nặng 4,784 gam. Khí đi ra khỏi ống sứ cho hấp thụ vào dung dịch Ba(OH)2 dư tạo thành 9,062 gam kết tủa.Tính thành phần phần trăm của khối lượng của từng chất trong hỗn hợp A.
PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1. Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
A. Ag. B. Na. C. Fe. D. Cu.
Câu 2. Ở nhiệt độ thường, kim loại Na phản ứng với H2O, thu được H2 và chất nào sau đây?
A. NaCl. B. Na2O. C. NaOH. D. Na2O2.
Câu 3. Kim loại nào sau đây là kim loại kiềm?
A. Ca. B. K. C. Cu. D. Al.
Câu 4. Khi so sánh với kim loại kiềm cùng chu kì, nhận xét nào dưới đây đúng về kim loại kiềm thổ?
A. Khối lượng riêng nhỏ hơn. B. Độ cứng lớn hơn.
C. Nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn. D. Thế điện cực chuẩn nhỏ hơn.
Câu 5. Để phân biệt dung dịch CaCl2 với dung dịch NaCl, người ta dùng dung dịch
A. HNO3. B. Na2CO3. C. NaNO3. D. KNO3.
Câu 6. Nước cứng là nước
A. chứa nhiều ion Ca2+ , Mg2+. B. chứa một lượng cho phép Ca2+ , Mg2+.
C. không chứa Ca2+ , Mg2+ D. chứa nhiều Ca2+ , Mg2+ , HCO3-.
Câu 7. Thạch cao nung có công thức hóa học là
A. CaCO3. B. CaSO4.2H2O. C. CaSO4. D. CaSO4.H2O.
Câu 8. Phát biểu nào sau đây không đúng với nhôm?
A. Ở ô thứ 12, chu kì 3, nhóm IIIA. B. Cấu hình electron nguyên tử: [Ne] 3s23p1.
C. Mức oxi hóa đặc trưng trong hợp chất là +3. D. Có 3 electron ở lớp ngoài cùng.
Câu 9. Sản phẩm của phản ứng nhiệt nhôm luôn có
A. Al. B. Al(OH)3. C. Al2O3. D. O2.
Câu 10. Cấu hình electron nào sau đây là của Fe?
A. [Ar] 4s23d6. B. [Ar]3d64s2. C. [Ar]3d8. D. [Ar]3d74s1.
Câu 11. Tính chất vật lý nào sau đây của sắt khác với các đơn chất kim loại khác?
A. Tính dẻo, dễ rèn. B. Có tính nhiễm từ. C. Dẫn điện và nhiệt tốt. D. Là kim loại nặng.
Câu 12. Phát biểu nào không đúng?
A. Gang là hợp chất Fe-C. B. Hàm lượng C trong gang nhiều hơn trong thép.
C. Gang là hợp kim Fe-C và 1 số nguyên tố khác. D. Gang trắng chứa ít C hơn gang xám.
Câu 13. Sắt(III) oxit có công thức hóa học là
A. Fe2O3. B. FeO. C. Fe3O4. D. Fe(OH)2.
Câu 14. Oxit lưỡng tính là
A. Cr2O3. B. MgO. C. CrO. D. CaO.
Câu 15. Các số oxi hoá đặc trưng của crom trong hợp chất là:
A. +2, +4, +6. B. +2, +3, +6. C. +1, +2, +4, +6. D. +3, +4, +6.
Câu 16. Chất khí nào sau đây là một trong các nguyên nhân gây ra hiệu ứng nhà kính?
A. SO2. B. CO2. C. NH3. D. N2.
Câu 17. Khi điều chế kim loại các ion kim loại đóng vai trò là chất
A. cho electron. B. bị khử. C. nhận proton. D. bị oxi hoá.
Câu 18. Kim loại kiềm có nhiệt độ nóng chảy thấp là do
A. khối lượng riêng nhỏ. B. tính khử của kim loại mạnh.
C. bán kính nguyên tử lớn. D. lực liên kết kim loại trong mạng tinh thể kém bền.
Câu 19. Trong các kim loại kiềm thổ: Mg, Ca, Sr, Ba. Kim loại có tính khử mạnh nhất là
A. Sr. B. Ca. C. Ba. D. Mg.
Câu 20. Sục 6,72 lít khí CO2 (đktc) vào dung dịch Ca(OH)2 dư. Kết thúc phản ứng khối lượng kết tủa thu được là
A. 15 gam. B. 25 gam. C. 20 gam. D. 30 gam.
Câu 21. Nhôm hiđroxit không phản ứng được với chất nào sau đây?
A. Dung dịch KOH. B. Dung dịch H2SO4. C. Dung dịch H2SO4 đặc nguội. D. Dung dịch NH3.
Câu 22. Cho các chất: Al, Al2O3, AlCl3, Al(OH)3. Số chất phản ứng được với dung dịch HCl là
A. 2. B. 3. C. 1. D. 4.
Câu 23. Cho Fe dư vào dung dịch H2SO4 loãng thu được 6,72 lít khí (ở điều kiện tiêu chuẩn). Khối lượng Fe tham gia phản ứng là
A. 16,8 gam. B. 5,6 gam. C. 25,2 gam. D. 11,2 gam.
Câu 24. Dãy gồm hai chất chỉ có tính oxi hoá là
A. Fe(NO3)2, FeCl3. B. Fe(OH)2, FeO. C. Fe2O3, Fe2(SO4)3. D. FeO, Fe2O3.
Câu 25. Chất rắn màu lục, tan trong dung dịch HCl được dung dịch A. Cho A tác dụng với NaOH và brom được dung dịch màu vàng, thêm tiếp H2SO4 vào thì thu được dung dịch có màu da cam. Chất rắn đó là
A. Cr2O3. B. CrO. C. CrO3. D. Cr.
Câu 26. Cho các phát biểu sau:
(1) Lưu huỳnh, photpho, cacbon đều phản ứng với CrO3;
(2) Bột nhôm dễ phản ứng với khí Cl2;
(3) Phèn chua có công thức là KAl(SO4)2.12H2O;
(4) Cr2O3 là oxit lưỡng tính.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
Câu 27. Ứng dụng nào sau đây không đúng?
A. Khi nghiền clanhke, trộn thêm thạch cao để điều chỉnh tốc độ đông cứng của xi măng.
B. Đá vôi được dùng làm vật liệu xây dựng, sản xuất vôi, xi măng, …
C. Khi nung nóng, thạch cao sống bị mất nước tạo thành thạch nhũ trong các hang động.
D. Vôi tôi được sử dụng rộng rãi trong công nghiệp và nông nghiệp.
Câu 28. Trường hợp nào sau đây thu được kết tủa sau khi phản ứng xảy ra hoàn toàn?
A. Sục khí CO2 dư vào dung dịch Ca(OH)2.
B. Cho dung dịch NaOH dư vào dung dịch HCl.
C. Cho dung dịch Na3PO4 vào dung dịch Ca(HCO3)2.
D. Cho CaCO3 vào dung dịch HCl loãng, dư.
PHẦN TỰ LUẬN.
Câu 29 (1 điểm): Cho m gam hỗn hợp X gồm Al, Cr tác dụng với lượng dư dung dịch HCl loãng nóng dư không có không khí, thu được 1,456 lít khí H2 (ở đktc). Cũng m gam hỗn hợp X tác dụng với lượng dư dung dịch NaOH đặc thu được 1,008 lít khí H2 (ở đktc).
a) Viết phương trình hóa học của các phản ứng xảy ra?
b) Tính m?
Câu 30 (1 điểm): Hoàn thành sơ đồ chuyển hóa sau:
Ca(OH)2  NaOH
NaOH  Fe(OH)3
Fe(OH)3 Fe2O3
Fe2O3 Al2O3
Al2O3
Câu 31 (0,5 điểm):Cho các dung dịch đựng riêng biệt trong các lọ mất nhãn sau: NH4Cl, NaCl, BaCl2, Na2CO3. Chỉ dùng thêm một thuốc thử, trình bày cách nhận biết 4 chất trên? Viết các phương trình hóa học của các phản ứng xảy ra(nếu có)?
Câu 32 (0,5 điểm): Hoà tan 5 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ thu được 0,56 lít khí H2 ở đktc và dung dịch A.
a) Tính % khối lượng mỗi chất trong hỗn hợp ban đầu?
b) Cho dung dich A tác dụng với dung dịch NaOH dư. Lấy kết tủa nung trong không khí đến khối lượng không đổi được m gam chất rắn X.(Biết hiệu suất các phản ứng là 100%). Tính m?